


 ,故答案为:Fe;C;
,故答案为:Fe;C; ;
;

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:0119 期中题 题型:填空题
 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表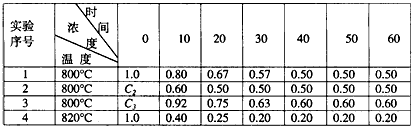
查看答案和解析>>
科目:高中化学 来源:2009-2010学年江苏省镇江市高三(上)期末化学试卷(解析版) 题型:解答题

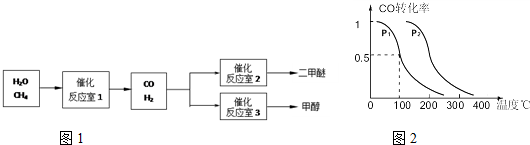
 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=______.
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=______. CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: CO(g)+2H2(g)反应的平衡常数为______(用含a、V的代数式表示).
CO(g)+2H2(g)反应的平衡常数为______(用含a、V的代数式表示).查看答案和解析>>
科目:高中化学 来源:2011年广东省茂名市电白一中高考化学二轮复习卷(四)(解析版) 题型:解答题

 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=______.
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=______. CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: CO(g)+2H2(g)反应的平衡常数为______(用含a、V的代数式表示).
CO(g)+2H2(g)反应的平衡常数为______(用含a、V的代数式表示).查看答案和解析>>
科目:高中化学 来源:2011年江西省重点中学联考高考化学一模试卷(解析版) 题型:解答题
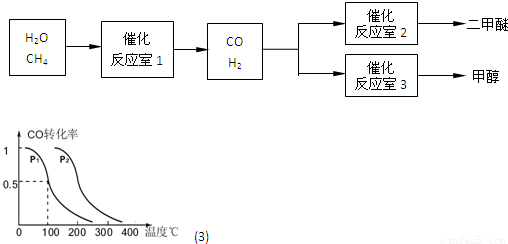
 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=______.
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=______. CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: CO(g)+2H2(g)反应的平衡常数为______(用含a、V的代数式表示).
CO(g)+2H2(g)反应的平衡常数为______(用含a、V的代数式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com