
【题目】根据题意解答
(1)从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强:铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,还原性最强;Cu2+、Fe2+、Ag+中,氧化性最强.
(2)铝与稀硝酸发生反应的化学方程式(未配平)为:Al+HNO3=Al(NO3)3+NO↑+H2O,该反应的氧化剂是(填化学式),配平上述反应,则反应中还原剂与氧化剂的物质的量之比是 , 当有5.4g Al发生反应时,转移电子的物质的量为 , 该反应的离子方程式为: .
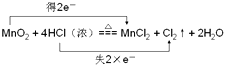
(3)MnO2与浓盐酸共热反应生成MnCl2、Cl2和H2O,写出该反应的化学方程式并用双线桥标出电子转移的方向和数目 .
(4)某一反应体系有反应物和生成物共六种物质:Cu(NO3)2、H2SO4、Cu2S、稀HNO3、H2O和NO,写出该反应的化学方程式 .
【答案】
(1)Fe;Ag+
(2)HNO3;1:1;0.6mol;Al+4H++NO3﹣=Al3++NO↑+2H2O
(3)
(4)3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O
【解析】解:(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,故还原性最强的是Fe;Cu2+、Fe2+、Ag+中氧化性强弱为Ag+>Cu2+>Fe2+ , 氧化性最强的是Ag+;所以答案是:Fe;Ag+;(2)已知Al+HNO3=Al(NO3)3+NO↑+H2O,HNO3→NO,氮元素化合价从+5降低为+2,HNO3是氧化剂,1molAl从0价升高为+3价,Al是还原剂,根据得失电子守恒配平方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O;
1molAl从0价升高为+3价,失去3mol电子,1molHNO3化合价从+5降低为+2得到3mol电子,所以还原剂与氧化剂的物质的量相等之比是1:1;
n(Al)= ![]() =
= ![]() =0.2mol,所以转移电子的物质的量为0.2mol×3=0.6mol;
=0.2mol,所以转移电子的物质的量为0.2mol×3=0.6mol;
Al和4HNO3反应的离子方程式为Al+4H++NO3﹣=Al3++NO↑+2H2O,
所以答案是:HNO3;1:1;0.6mol;Al+4H++NO3﹣=Al3++NO↑+2H2O;(3)MnO2与浓盐酸共热反应生成MnCl2、Cl2和H2O中锰元素化合价从+4价降低到+2价;得到电子被还原;HCl中的氯元素化合价从﹣1价升高到0价失去电子被氧化;电子转移双线桥标为: 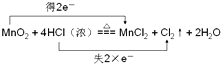 ;
;
所以答案是:  ;(4)反应中稀HNO3具有强氧化性为反应物生成NO,N元素化合价由+5价降低为NO中+2价,共降低3价,Cu2S具有强还原性为反应物生成Cu(NO3)2和H2SO4 , Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由﹣2升高为+6,总共升高10价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒,则方程式为:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O,
;(4)反应中稀HNO3具有强氧化性为反应物生成NO,N元素化合价由+5价降低为NO中+2价,共降低3价,Cu2S具有强还原性为反应物生成Cu(NO3)2和H2SO4 , Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由﹣2升高为+6,总共升高10价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒,则方程式为:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O,
所以答案是:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O.


科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2和SO3,下列说法中一定正确的是( )
A. 硫元素的质量比为5∶4 B. 分子数之比为1∶1
C. 原子总数之比为4∶3 D. 体积之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为____(填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是____;如果不能直接投入,应将贝壳作何处理____,试写出化学方程式_______。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为_______(填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他___(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是________。(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10-3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)配制一定物质的量浓度溶液时,会使所配溶液浓度偏高的是(填序号)
a.容量瓶在使用前内壁沾有水珠 b.定容时俯视读刻度
c.未冷却至室温就注入容量瓶并马上定容 d.向容量瓶转移液体时有少量流出
(2)容量瓶上标有(填序号)
①温度 ②浓度 ③容量 ④质量 ⑤刻度线 ⑥酸式或碱式
(3)将4g NaOH 固体溶解在10mL的水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度是 .
(4)溶液、胶体和浊液这三种分散系的本质区别是(填序号),
A.是否是大量分子或离子的集合体 B.分散质粒子的大小
C.是否能通过滤纸 D.是否均一、透明、稳定
光束通过Fe(OH)3胶体时,可看到光亮的通路,这种现象叫 .
(5)实验室制取氯气的反应方程式是:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,在此反应中,被氧化的元素是 , 还原产物是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知31g白磷变成31g红磷放出18.39KJ热量,下面两个反应:
4P(白,s) + 5O2(g)=2P2O5(s) △H1
4P(红,s) + 5O2(g)=2P2O5(s) △H2
则△H1和 △H2的关系是 ( )
A. △H1>△H2 B. △H1=△H2 C. △H1< △H2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/LNH4Cl溶液中离子浓度大小顺序正确的是( )
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(NH4+) >c(Cl-)>c(H+)>c(OH-)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+) D. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com