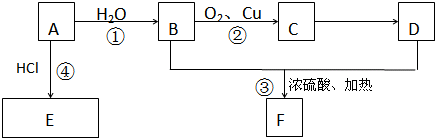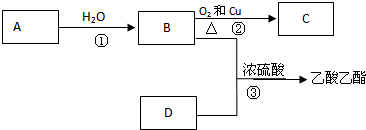
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
,向其中加入少量KOH溶液时,发生反应的离子方程式是
(2)现将0.04mol?L
-1HA溶液和0.02mol?L
-1NaOH溶液等体积混合,得到缓冲溶液.①若HA为HCN,该溶液显碱性,则溶液中c(Na
+)
c(CN
-)(填“<”、“=”或“>”),你得出该结论的依据是
②若HA为CH
3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH
3COOH溶液中存在电离平衡:CH
3COOH?CH
3COO
-+H
+△H>0.
(1)常温下,在 pH=5的稀醋酸溶液中,c(CH
3COO
-)=
(列式,不必化简);下列方法中,可以使0.10mol?L
-1 CH
3COOH的电离程度增大的是
?
a.加入少量0.10mol?L
-1的稀盐酸 b.加热CH
3COOH溶液c.加水稀释至0.010mol?L
-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L
-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)
V(醋酸),反应的最初速率为:v(盐酸)
v(醋酸).(填写“>”、“<”或“=”)
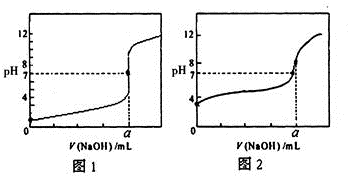
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L
CH
3COOH,得到如图所示两条滴定曲线,请完成有关问题:
①NaOH溶液滴定CH
3COOH溶液的曲线是
(填“图1”或“图2”);
②a=
mL.
(4)常温下,将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为
.
(5)已知:90℃时,水的离子积常数为Kw=3.80×10
-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H
+)=
(保留三位有效数字)mol/L.

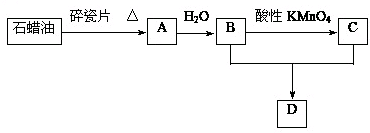
 ,
, ;
;

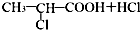
 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.