
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气压强不变 | D. | 氧气的浓度变大 |
分析 保持温度不变,缩小容器体积,增大压强,平衡向气体体积减小的方向进行,反应2BaO2(s)?2BaO(s)+O2(g)是气体体积增大的反应,增大压强该可逆反应向逆反应方向移动,化学平衡常数只与温度有关,依据平衡常数表达式分析氧气的浓度变化,据此分析选项解答.
解答 解:A.化学平衡常数只与温度有关,保持温度不变,缩小容器容积,温度不变平衡常数不变,故A错误;
B.缩小容器体积,增大压强,平衡向逆反应方向移动,则BaO的量减小,故B错误;
C.平衡向逆反应方向移动,但温度不变,平衡常数不变,氧气浓度不变,其压强不变,故C正确;
D.平衡向逆反应方向移动,但温度不变,K=[O2],平衡常数不变,氧气浓度不变,故D错误;
故选C.
点评 本题考查了可逆反应平衡移动,根据压强与平衡移动方向之间的关系分析解答即可,注意平衡常数只与温度有关,与物质浓度无关,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 标准状况下,22.4L NO 和22.4L O2混合后所得气体中分子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、OH- | B. | Na+、CO32-、OH- | C. | Fe2+、H+、CO32- | D. | Fe3+、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | Al | C. | Mg | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
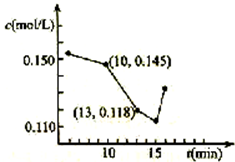 对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:
对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | 乙酸的结构示意图:C2H4O2 | |
| C. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| D. | 氯化钠的电子式: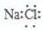 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com