
水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(2)用“>”、“<”或“=”填空: 碱性溶液中,c(H+) c(OH-),在常温时pH 7。
(3)有下列几种溶液:A. NH3·H2O B. CH3COONa C. NH4Cl D. NaHSO4
常温下呈酸性的溶液有 (填序号)
用离子方程式或电离方程式表示这些溶液呈酸性的原因:___________________________________。
【答案】(1)1×10-14;(2)<;=;(3)C、D;NH4++H2O NH3·H2O+H+;NaHSO4=Na++H++SO42-。
NH3·H2O+H+;NaHSO4=Na++H++SO42-。
【解析】
试题分析:(1)水电离产生的H+、OH-离子浓度的乘积是个常数,这个产生就是离子积常数Kw, 在室温下c(H+)·c(OH-)=1×10-14;(2) 碱性溶液中,c(H+)< c(OH-),在常温时pH>7。(3) A. NH3·H2O是弱碱,电离产生OH-,因此溶液显碱性,错误;B. CH3COONa是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使溶液中OH-的浓度大于H+的浓度,所以溶液显碱性,错误;C. NH4Cl是强酸弱碱盐,弱碱酸根离子水解消耗水电离产生的OH-,最终,使溶液中H+的浓度大于OH-的浓度,所以溶液显酸性,水解的两种方程式是NH4++H2O NH3·H2O+H+;正确;D. NaHSO4是强酸的酸式盐,电离产生离子,使溶液显酸性,电离方程式是:NaHSO4=Na++H++SO42-。正确。
NH3·H2O+H+;正确;D. NaHSO4是强酸的酸式盐,电离产生离子,使溶液显酸性,电离方程式是:NaHSO4=Na++H++SO42-。正确。
考点:考查溶液的酸碱性、水的离子积常数、电离方程式、水解的离子方程式的书写的知识。


科目:高中化学 来源: 题型:
A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
 (1)CB3分子中心原子的杂化类型是 。
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内写出对应的元素符号
(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中括号内的物质是杂质,试将除杂试剂和分离方法填入表中:
| 混合物 | SiO2(CaCO3) | SiO2 (Fe2O3) | SiO2 (NaCl) | SiO2 (Si) | Si (Al) | NaHCO3 (Na2SiO3) |
| 除杂试剂 | ||||||
| 分离方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池装置如下图所示。下列有关叙述中,正确的是
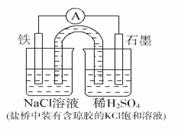
A.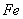 作正极,发生氧化反应 B. 工作一段时间后,两烧杯中溶解
作正极,发生氧化反应 B. 工作一段时间后,两烧杯中溶解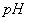 均不变
均不变
C.负极反应: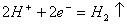 D. 工作一段时间后,NaCl溶液中c(Cl-)增大
D. 工作一段时间后,NaCl溶液中c(Cl-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
大气污染问题已成影响环境的重要因素,有人想利用2CO(g)+SO2(g) 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
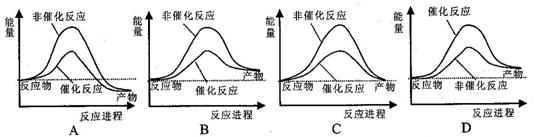
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常用天然气作为制备甲醇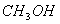 的原料。已知:
的原料。已知:
①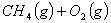
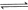

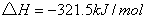
②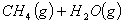
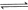
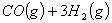
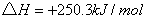
③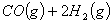
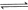
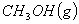

 与
与 反应生成
反应生成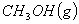 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入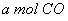 与
与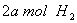 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。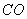 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示:
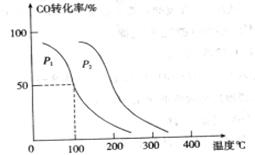
①压强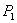
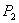 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在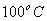 、
、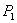 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含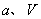 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X+的核外各层电子数分别为2、8,则X元素在周期表中的位置是( )
A.第2周期第0族 B.第3周期第ⅠA族
C.第2周期第ⅠA族 D.第2周期第ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.碱性:LiOH > NaOH > KOH > RbOH
B.金属性:Rb > K > Na > Li
C.和酸反应时Fe失2个e-,Na失1个e-则Fe的金属性强于Na
D.Rb不易与水反应放出H2
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com