
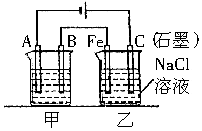
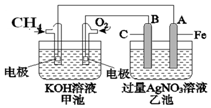
 如图所示甲、乙为相互串联的两电解池.试回答:
如图所示甲、乙为相互串联的两电解池.试回答:分析 (1)依据电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,在阴极是溶液中铜离子得到电子生成铜;
(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极失电子发生氧化反应,Fe为阴极得电子发生还原反应;
(3)依据电极反应电子守恒计算甲池和乙池中电极产物的物质的量,乙池中依据氢离子和氢氧根离子守恒,水的离子积常数计算得到.
解答 解:(1)电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(CuSO4溶液或CuCl2溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e-═Cu,
故答案为:阴;精铜(或纯铜); Cu2++2e-=Cu;
(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极,电极反应为:2Cl--2e-═Cl2↑;Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,破坏水的电离平衡氢氧根离子浓度增大,铁电极附近溶液变红色,
故答案为:2Cl--2e-═Cl2↑;红;
(3)甲池A为电解池的阴极,电极反应为Cu2++2e-═Cu,增重1.28g的铜物质的量为0.02mol,转移电子物质的量为0.04mol;
乙池Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,依据电子守恒,生成氢气0.02mol,放出气体在标况下的体积为0.02mol×22.4L/mol=0.448L,依据水的电离氢离子和氢氧根离子守恒得到,生成氢氧根离子物质的量为0.04mol,c(OH-)=$\frac{0.04mol}{0.4L}$=0.1mol/L,溶液pH=13;
故答案为:0.448L;13.
点评 本题考查了电解原理,明确各个电极上放电的离子是解本题关键,再结合转移电子守恒进行计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 体积分数为75%的酒精溶液会使细菌蛋白质变性 | |
| B. | 1 mol甲烷和1 mol氯气在光照条件下充分反应,生成的CH3Cl少于1 mol | |
| C. | 除去乙酸乙酯中少量的乙酸:用饱和氢氧化钠溶液洗涤,并分液、干燥、蒸馏 | |
| D. | 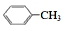 的一溴代物和 的一溴代物和 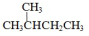 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气混合光照 | |
| B. | 石油裂解制丙烯 | |
| C. | 乙醇与乙酸反应制乙酸乙酯 | |
| D. | 苯与浓硝酸及浓硫酸混合加热到55℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球浸没在蒸馏烧瓶的液体中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,用酒精萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
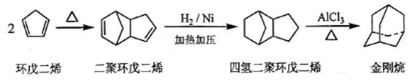
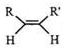 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO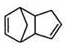 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$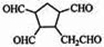 .
.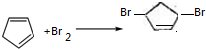 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个化学过程的示意图.请回答下列问题:
如图是一个化学过程的示意图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 平衡将向逆反应方向移动 | ||
| C. | 平衡不发生移动 | D. | 容器内气体的密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com