
下列物质中,既含离子键又含共价键的是
A. HCl B. NaOH C. NaCl D. O2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、B、C、D四种元素均为短周期元素,原子序数依次增大。
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, 纯净的Z是现代光学及光纤制品的基本原料,可与氢氟酸反应。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示)_____________________________________
(2)M可以使溴水褪色,写出该反应的离子方程式
(3)Z与氢氟酸反应的化学方程式
(4)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的化学方程式为
(5)D元素离子的电子结构示意图为__________
D在纯氧中燃烧产物里DO3含量 D在空气中燃烧产物里DO3含量。
用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单
质,该方法的优点是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A. ②⑤ B. ①② C. ①②④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列从反应物到生成物能通过化合反应一步制得的是(其他反应物自选)( )
A.Al2O3―→Al(OH)3
B.Fe(OH)2―→Fe(OH)3
C.Na2O2―→NaOH
D.NaAlO2―→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
以铝屑为原料制备Al(OH)3实验方案的设计
(1)设计方案一:用稀硫酸跟铝屑反应,使铝转化为Al3+的溶液,再用NaOH溶液使Al(OH)3沉淀析出。
化学方程式:_________________________________。
(2)设计方案二:将铝屑跟浓NaOH溶液反应,再用稀硫酸中和过量的碱液,并促使AlO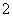 水解,以得到Al(OH)3。
水解,以得到Al(OH)3。
化学方程式:_________________________________。
(3)设计方案三:用铝屑分别与稀硫酸和浓NaOH溶液反应,然后将得到的铝盐溶液混合过滤,再将得到的沉淀洗涤,即可得到Al(OH)3。
化学方程式:_________________________________。
(4)计算方案一、方案二和方案三中酸、碱的用量填写下表:
| 方案 | 生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| 方案一 | ||
| 方案二 | ||
| 方案三 |
(5)对于上述三种设计方案,从反应物种类看,三种方案都使用了三种药品。从消耗酸、碱的物质的量来分析,方案________用量最多,方案________用量最少;从操作要求考虑,方案________也最为简单。
查看答案和解析>>
科目:高中化学 来源: 题型:
某原子核内的质子数为m,中子数为n,则下述论断正确的是( )
A.原子核内中子的总质量小于质子的总质量;
B.该原子的质量数等于m-n;
C.该元素的相对原子质量近似等于m+n;
D.该原子的相对原子质量近似等于m+n。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com