
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.分析 (1)镓是31号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)计算SeO3分子中Se原子的价层电子对数、孤对电子数,可以判断分子构型;
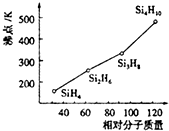
(4)硅烷(SinH2n+2)都是分子晶体,相对分子质量越大,分子间作用力越强,晶体沸点越高;
(5)[B(OH)4]-中B的价层电子对=4+$\frac{1}{2}$×(3+1-4×1)=4,杂化轨道数目为4;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子Cu(NH3)42+,两者相互促进使反应进行;
(7)利用均摊法确定晶胞中各种原子的个数,结合晶胞中原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算密度;
解答 解:(1)镓是31号元素,核外电子排布式为:1s22s22p63s23p63d104s24p1,
故答案为:1s22s22p63s23p63d104s24p1;
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故答案为:Br>As>Se;
(3)气态SeO3分子中中心原子的价层电子对数为3+$\frac{6-2×3}{2}$=3,无孤电子对,所以分子构型为平面三角形,
故答案为:平面三角形;
(4)硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强,晶体的沸点越高,
故答案为:硅烷的相对分子质量越大,分子间范德华力越强;
(5)[B(OH)4]-中B的价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,所以采取sp3杂化,
故答案为:sp3;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O,
故答案为:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(7)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=$\frac{\frac{197+64×3}{{N}_{A}}g}{(a×1{0}^{-10}cm)^{3}}$=$\frac{197+64×3}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3,
故答案为:1:3;$\frac{197+64×3}{{N}_{A}×(a×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、第一电离能、分子空间构型、杂化方式、晶胞计算,注意理解同周期第一电离能异常情况,难度中等.


科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+Cl2═2HCl | B. | CuO+2H+═Cu2++H2O | ||
| C. | H2O+CaO═Ca(OH)2 | D. | NaOH+HCl═H2O+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g ND3中所含分子数目NA | |
| B. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
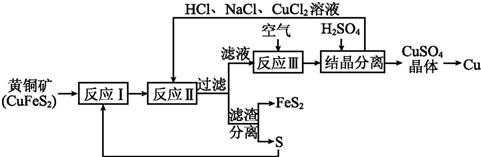
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
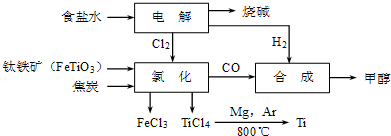
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com