
| A. | 电解质溶液中混入水,会影响电池反应 | |
| B. | 反应中,SOCl2既是溶剂,又是氧化剂 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2) 被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫物质的量之比为4:1 |
分析 A、金属锂可以和水反应,则电解质应为非水溶液;
B、SOCl2中S元素的化合价由+4价降低为0;
C、亚硫酰氯被还原为S;
D、由8Li+3SOCl2═6LiCl+Li2SO3+2S~8e-计算.
解答 解:A、金属锂可以和水反应,在该电池中,电解质溶液中混入水,会影响电池反应,故A正确;
B、电池的总反应式8Li+3SOCl2═6LiCl+Li2SO3+2S,SOCl2中S元素的化合价由+4价降低为0,作氧化剂,所以SOCl2既是溶剂,又是氧化剂,故B正确;
C、电池的总反应式8Li+3SOCl2═6LiCl+Li2SO3+2S,即SOCl2中S由+4价还原为S为0价,不是被还原为Li2SO3,故C错误;
D、根据电池的总反应式:8Li+3SOCl2═6LiCl+Li2SO3+2S,负极消耗的锂与正极生成的硫物质的量之比为8:2=4:1,故D正确;
故选C.
点评 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数均为K=2 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O和Na2O2的混合物中,阴阳离子总数为3NA | |
| B. | 非标准状况下,NA个CO2分子所占的条件不可能为22.4L | |
| C. | 24.4gNa2O•SiO2中含有0.2NA个SiO2分子 | |
| D. | 56gFe投入1000mL3.5mol•L-1稀硝酸中,充分反应,转移电子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
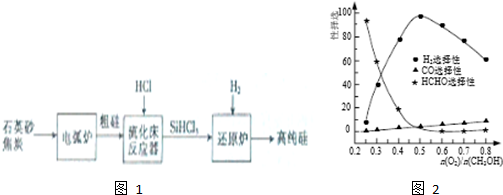
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
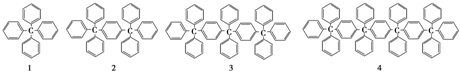
| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S和KNO3都是反应的氧化剂 | B. | C在反应中得电子 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com