
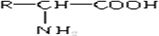 ,其分子中一定含有羧基(-COOH)和
,其分子中一定含有羧基(-COOH)和 是一种重要的合成材料,契单体的结构简式为
是一种重要的合成材料,契单体的结构简式为
| 醇 |
| △ |
| 醇 |
| △ |


科目:高中化学 来源: 题型:
| A、明矾可除去水中的悬浮颗粒等杂质,所以可用作净水剂 |
| B、黄瓜含有丰富的维生素C,热锅爆炸能减少维生素C的流失 |
| C、石英玻璃纤维传导光的能力非常强,所以常用于光缆通信 |
| D、可用燃烧的方法鉴别羊毛围巾和合成纤维围巾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解饱和食盐水是氯碱工业的基础.以下是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水.通电几分钟后,将湿润的碘化钾淀粉试纸放在A电极一端的管口,试纸变蓝色.请回答:
电解饱和食盐水是氯碱工业的基础.以下是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水.通电几分钟后,将湿润的碘化钾淀粉试纸放在A电极一端的管口,试纸变蓝色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O |
| B、氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ |
| C、碳酸氢钠和稀硫酸反应:HCO3-+H+═CO2↑+H2O |
| D、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com