
(已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
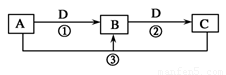
请回答下列问题:
若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质
①加热蒸干B的溶液不能得到B,则B的化学式可能是________________;工业上制取A的离子方程式为__________________________________。
②用A制备漂白粉的化学方程式是________________________________________________。反应②的离子方程式是______________________________________________________,配制C的溶液时可加入少量的______(填物质名称)以抑制水解。
(2)若A是某强酸的稀溶液,则A的化学式可能是________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________。
(4)若A、B、C的的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是______或______(填化学式),鉴别这两种气态酸性氧化物常可选用________________(填一种试剂名称)。
(1)
①FeCl3 (2分) 2Cl-+2H2O 2OH-+Cl2↑+H2↑(2分)
2OH-+Cl2↑+H2↑(2分)
②2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2分) Fe+2Fe3+=3Fe2+ (2分) 盐酸(2分)
(2)HNO3(2分,只要符合题意都给分)
(3)Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2- + 2H2O (2分)
(4)CO2 SO2 品红溶液、溴水或酸性高锰酸钾溶液等(共3分,每空1分。只要符合题意都给分)
【解析】
试题分析:(1)根据D是生产、生活中用量最大、用途最广的金属单质可判断D为Fe。
①若A可用于自来水消毒,则A为Cl2。氯气与铁反应生成氯化铁,则B是氯化铁。工业上通过电解饱和食盐水制备氯气,所以工业上制取A的离子方程式为2Cl-+2H2O 2OH-+Cl2↑+H2↑。
2OH-+Cl2↑+H2↑。
②用氯气制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氯化铁与铁反应生成氯化亚铁,则C为FeCl2,所以反应②的离子方程式为Fe+2Fe3+=3Fe2+。亚铁离子易水解,因此配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解。
(2)若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,因此可判断为HNO3。
(3)若D是氯碱工业的主要产品之一,B有两性,所以B为两性氢氧化物为Al(OH)3,因此D是氢氧化钠,所以能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+,则反应②的离子方程式是Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2- + 2H2O。
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2。SO2具有漂白性和还原性,因此可以用品红溶液、溴水或酸性高锰酸钾溶液等鉴别。
考点:考查物质推断的有关判断


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com