
| A. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| B. | 0.1 mol CnH2n+2中含有的共用电子对数为0.3nNA | |
| C. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| D. | 电解精炼铜时,阳极质量减少64g,则阴极得到的电子数为2NA |
分析 A、标况下二氯甲烷为液态;
B、CnH2n+2中含(n-1)条C-C键和(2n+2)条C-H键;
C、NO2和N2O4的最简式均为NO2;
D、电解精炼铜时,阳极上放电的不止是铜.
解答 解:A、标况下二氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、CnH2n+2中含(n-1)条C-C键和(2n+2)条C-H键,故1molCnH2n+2中含(3n+1)NA对共用电子对,故0.1molCnH2n+2中含0.1(3n+1)NA对共用电子对,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,则含有2NA个氧原子,故C正确;
D、电解精炼铜时,阳极上放电的不止是铜,故当阳极上减少64g时,转移的电子数并不是2NA个,则阴极上得到的电子数也不是2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题

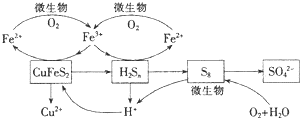
| A. | 由CuFeS2生成Cu2S,SO2和铁的氧化物反应中硫元素被还原 | |
| B. | 熔炼过程中的主要反应为:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 铜的电解精炼过程中纯铜做阳极 | |
| D. | 上述冶炼过程产生大量SO2,通常用饱和NaHSO3溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取试剂瓶中的碳酸钠溶液时,发现取量过多,为了不浪费立即把多余的试剂倒入原试剂瓶中 | |
| B. | 硝酸钡溶于水,故可将含硝酸钡的废液倒入水槽,再用水冲入下水道 | |
| C. | 用蒸发的方法使氯化钠从溶液中析出,应将蒸发皿中的氯化钠溶液全部加热蒸干 | |
| D. | 稀释浓硫酸时,将浓硫酸缓缓注入水中,并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2能引起温室效应,是一种大气污染物 | |
| B. | 硫是一种黄色晶体,不溶于水,微溶于酒精 | |
| C. | SO2能使品红溶液褪色是因为它具有漂白性 | |
| D. | NO2和SO2是主要的大气污染物,溶于水后可能形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
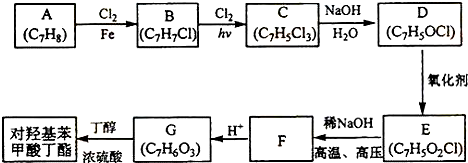
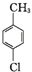 +2Cl2$\stackrel{hv}{→}$
+2Cl2$\stackrel{hv}{→}$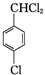 +2HCl,该反应过程中涉及的反应类型是取代反应.
+2HCl,该反应过程中涉及的反应类型是取代反应.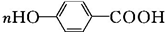 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$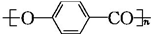 +nH2O.
+nH2O. ,D与银氨溶液发生反应的化学方程式为
,D与银氨溶液发生反应的化学方程式为 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$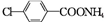 +H2O+2Ag↓+3NH3.
+H2O+2Ag↓+3NH3.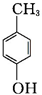 为原料制备G(
为原料制备G(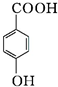 )的合成路线:
)的合成路线: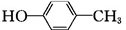 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$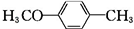 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$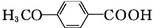 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$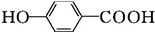 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com