
| A. | 5min内用B表示的反应速率为0.018mol/(L•min) | |
| B. | 在该温度下反应的平衡常数为900 | |
| C. | A和B的平衡转化率都为90% | |
| D. | 如果加压,平衡正向移动,可使△H 减小 |
分析 5min后达到平衡,共放出热量17.64kJ,则反应消耗B的物质的量为:$\frac{17.64kJ}{196kJ/mol}$=0.09mol,
2A(g)+B(g)?2C(g)
起始(mol)0.2 0.1 0
转化(mol)0.18 0.09 0.18
平衡(mol)0.02 0.01 0.18
A.根据反应速率v=$\frac{\frac{△n}{V}}{△t}$计算出5min内用B表示的反应速率;
B.分别计算出A、B、C的物质的量,然后带入平衡常数的表达式计算即可;
C.A、B的转化率相等,根据转化率=$\frac{反应消耗的物质的量}{初始物质的量}$×100%计算;
D.化学计量数不变,则焓变值不会发生变化.
解答 解:5min后达到平衡,共放出热量17.64kJ,则反应消耗B的物质的量为:$\frac{17.64kJ}{196kJ/mol}$=0.09mol,
2A(g)+B(g)?2C(g)
起始(mol)0.2 0.1 0
转化(mol)0.18 0.09 0.18
平衡(mol)0.02 0.01 0.18
A.5min内用B表示的反应速率为:$\frac{\frac{0.09mol}{2L}}{5min}$=0.009mol/(L•min),故A错误;
B.平衡时A、B、C的浓度分别为:c(A)=$\frac{0.02mol}{2L}$0.01mol/L、c(B)=$\frac{0.01mol}{2L}$=0.005mol/L、c(C)=$\frac{0.18mol}{2L}$=0.09mol/L,则该温度下该反应的平衡常数=$\frac{0.0{9}^{2}}{0.0{1}^{2}×0.005}$=1800,故B错误;
C.A的转化率为:$\frac{0.18mol}{0.2mol}$×100%=90%,A、B的物质的量之比等于其计量数之比,则二者的转化率相等,都是90%,故C正确;
D.热化学方程式的焓变与化学计量数成正比,加压后平衡正向移动,但是焓变值不变,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L的稀盐酸1L | B. | 73g HCl | ||
| C. | 44.8 L HCl | D. | 1.204×1024个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 项 | B. | 1 项 | C. | 2 项 | D. | 3 项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0004mol/(L•min) | B. | 0.0002mol/(L•s) | C. | 0.0016 | D. | 0.012 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:实验题
某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:
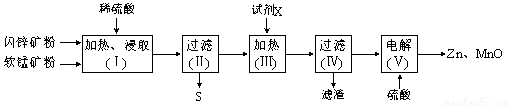
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 。
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: 。
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3。pH调节的范围是 ,试剂X可以选用 (填选项字母)。
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3·H2O
(4)电解(Ⅴ)中阳极的电极反应式为 。
(5)Zn和MnO2是制作电池的原料。某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。该电池的正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com