
| A. | 2p能级上只有1个空轨道的原子和3p能级上只有1个空轨道的原子 | |
| B. | 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子 | |
| C. | 最外层电子排布为ns2的原子和最外层电子排布为ns2np6的原子 | |
| D. | 2p能级上有2个未成对电子的原子和3p能级上有2个未成对电子的原子 |
分析 A.2p能级上只有1个空轨道的原子为C元素,3p能级上只有1个空轨道的原子为Si元素;
B.最外层电子排布为4s2的原子有Ca、V、Mn、Co、Ni、Zn等元素;
C.最外层电子排布为ns2的元素可能为主族或副族,最外层电子排布为ns2np6的原子为零族元素;
D.p轨道上有2个未成对电子,可能为2或4.
解答 解:A.2p能级上只有1个空轨道的原子为C元素,3p能级上只有1个空轨道的原子为Si元素,则相应元素一定属于同一主族,故A正确;
B.最外层电子排布为3s2的原为Mg,最外层电子排布为4s2的原子有Ca、V、Mn、Co、Ni、Zn等元素,故B错误;
C.最外层电子排布为ns2的元素可能为主族或副族,最外层电子排布为ns2np6的原子为零族元素,所以相应元素一定不属于同一主族,故C错误;
D.p轨道上有2个未成对电子,可能为2或4,不能确定元素的种类,则不一定为同一主族,故D错误.
故选:A.
点评 本题考查原子的结构与元素周期表的关系,注意把握原子核外电子的排布特点,题目难度不大,注意相关基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等 | |
| C. | 若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲 | |
| D. | 若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯发生的是取代反应 | |
| C. | C5H10不属于烷烃,而C5H12属于烷烃且有3种同分异构体 | |
| D. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH | B. | HOOC-COOH | C. | HOCH2CH2COOH | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
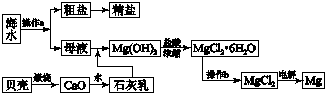
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| D. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物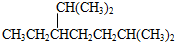 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使高锰酸钾溶液褪色 | |
| D. | 结构片段为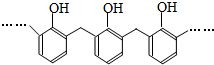 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com