
某同学测定镀锌铁皮锌镀层厚度,步骤如下:
(1)测量三块镀锌铁皮的长度与宽度,记录数据。
(2)用电子天平分别测量三块镀锌铁皮的质量。
(3)将镀锌铁皮放入烧杯中,加入盐酸,反应时应小心将铁片翻动,该操作的目的是________________________________________________________________________。
若没有此类操作,则测得的锌镀层厚度
________________________________________________________________________。
当反应速率显著减小时,立即取出铁片并
________________________________________________________________________,
该操作的目的是
________________________________________________________________________。
(4)将铁片放在石棉网上,用小火烘干,该操作的目的是______________________________。若不烘干,则计算得到的锌镀层厚度结果将____________。若改用酒精灯持续加强热,则会造成________________________________________________________________________。
(5)根据实验数据,完成下表,求出镀锌铁皮的锌镀层厚度(锌的密度取7.14 g·cm-3)。
|
数据记录 |
数据处理 |
||
|
镀锌铁皮A长4.94 cm、宽4.90 cm 镀锌铁皮B长5.05 cm、宽5.00 cm 镀锌铁皮C长5.05 cm、宽4.90 cm 镀锌铁皮A m1(A)=2.455 g 镀锌铁皮B m1(B)=2.508 g 镀锌铁皮C m1(C)=2.500 g 镀锌铁皮A m2(A)=2.201 g 镀锌铁皮B m2(B)=2.247 g 镀锌铁皮C m2(C)=2.238 g |
镀锌铁 皮编号 |
镀锌铁 皮厚度 (单侧) /cm |
镀锌铁 皮平均 厚度(单 侧)/cm |
|
镀锌 铁皮A |
|
|
|
|
镀锌 铁皮B |
|
||
|
镀锌 铁皮C |
|
(3)使Zn充分反应 偏低 冲洗铁片上的酸液体 避免铁被腐蚀 (4)除去水分 偏低 铁片氧化
(5)
|
镀锌铁皮厚度(单侧)/cm |
镀锌铁皮平均厚度(单侧)/cm |
|
7.348×10-4 |
7.334×10-4 |
|
7.239×10-4 |
|
|
7.415×10-4 |
【解析】
试题分析:反应时小心地将铁片翻动,是为了使Zn与盐酸充分反应;在盐酸中,Zn与Fe构成原电池,因为Zn的活泼性比Fe的强,Zn失去电子被氧化,随着Zn的消耗,原电池作用减弱,反应速率减慢,当反应速率显著减小时,说明Zn与盐酸反应完成。根据公式:h=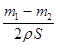 可以知道当Zn反应不完全、铁片不干燥或铁片被氧化时都会使h减小,也可以根据上述公式计算出镀锌铁皮的厚度。
可以知道当Zn反应不完全、铁片不干燥或铁片被氧化时都会使h减小,也可以根据上述公式计算出镀锌铁皮的厚度。
考点:考查测定镀锌铁皮锌镀层厚度的实验设计、基本操作,数据的分析和处理
点评:综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。该类试题要求学生能够具备通过对自然界、生产、生活和科学实验中化学现象以及相关模型、图形和图表等的观察,获取有关的感性知识和印象,并运用分析、比较、概括、归纳等方法对所获取的信息进行初步加工和应用的能力。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了测定镀锌铁皮锌镀层的厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮放入6mol/LHCl溶液中,当气泡产生速率显著减小时,取出铁片,用水冲洗,烘干称量,称得的质量为m2。下列说法不正确的是
A、当铁片产生气泡速率减慢时,立即取出铁片,不冲洗就用酒精灯加热烘干,铁片可能继续与残留的酸反应,导致实验结果偏高
B、试验中产生气泡的速率是先慢,然后逐渐加快,再显著减慢,这是微电池和温度共同影响的结果
C、锌和铁在酸溶液中形成原电池,外电路中电流从铁流向锌。
D、设锌镀层为h,锌的密度为ρ,则h = (m1— m2)/2ρS
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
某同学设计了测定镀锌铁皮锌镀层的厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮放入6mol/LHCl溶液中,当气泡产生速率显著减小时,取出铁片,用水冲洗,烘干称量,称得的质量为m2。下列说法不正确的是
A、当铁片产生气泡速率减慢时,立即取出铁片,不冲洗就用酒精灯加热烘干,铁片可能继续与残留的酸反应,导致实验结果偏高
B、试验中产生气泡的速率是先慢,然后逐渐加快,再显著减慢,这是微电池和温度共同影响的结果
C、锌和铁在酸溶液中形成原电池,外电路中电流从铁流向锌。
D、设锌镀层为h,锌的密度为ρ,则h = (m1— m2)/2ρS
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com