
�״���һ�ֺܺõ�ȼ��,��ҵ����CH4��H2OΪԭ��,ͨ����Ӧ��͢����Ʊ��״���
(1)��1.0 mol CH4��2.0 mol H2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊ100 L),��һ�������·�����Ӧ:CH4(g)+H2O(g) CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��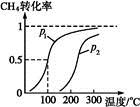
����֪100 ��ѹǿΪp1ʱ�ﵽƽ�������ʱ��Ϊ5 min,����H2��ʾ��ƽ����Ӧ����Ϊ����������
��ͼ�е�p1��������p2(�<����>����="��),100" ��ѹǿΪp2ʱƽ�ⳣ��Ϊ����������
�۸÷�Ӧ�Ħ�H��������0(�<����>����=��)��
(2)��һ��������,��a mol CO��3amol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״�: CO(g)+2H2(g) CH3OH(g)����H<0 ������
CH3OH(g)����H<0 ������
���������ݻ�����,���д�ʩ�����Ӽ״����ʵ���(����)
A.�����¶�
B.��CH3OH(g)����ϵ�з���
C.����He,ʹ��ϵ��ѹǿ����
D.�ٳ���1 mol CO��3 mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ����������,ijͬѧ���������ʵ��,����ʵ�������Ѿ���������ʵ������С�
A.�±���ʣ���ʵ����������:a=��������;b= ��
��
B.���ݷ�Ӧ����ص�,��ͼ����ѹǿ�ֱ�Ϊ0.1 MPa��5 MPa��CO��ת�������¶ȱ仯������ͼ,��ָ��ͼ�е�ѹǿpx=��������MPa��
| ʵ���� | T/�� | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
(1)��0.003 0 mol��L-1��min-1����<��2.25��10-4����>
(2)��BD����150����0.1
����(1)��v(H2)=3v(CH4)= ��3="0.003" 0 mol��L-1��min-1;�����ݷ�Ӧʽ��֪����ѹǿƽ������,ת���ʼ�С,����p1<p2;�á����������������100 ��ѹǿΪp1ʱƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CH4)="0.005" mol��L-1��c(H2O)="0.015" mol��L-1��c(CO)="0.005" mol��L-1��c(H2)="0.015" mol��L-1,K=
��3="0.003" 0 mol��L-1��min-1;�����ݷ�Ӧʽ��֪����ѹǿƽ������,ת���ʼ�С,����p1<p2;�á����������������100 ��ѹǿΪp1ʱƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CH4)="0.005" mol��L-1��c(H2O)="0.015" mol��L-1��c(CO)="0.005" mol��L-1��c(H2)="0.015" mol��L-1,K=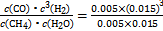 =2.25��10-4;(2)��Cѡ���൱�ڼ�ѹ��Dѡ���൱�ڼ�ѹ;�����ʵ��Ӧ��ֻ��һ������,ʵ��1��2ѹǿ��ͬ,�¶���ͬ;ʵ��2��3�¶Ȳ�ͬ,������ͬ;ѹǿԽ��ת����Խ��,px��ѹǿС��
=2.25��10-4;(2)��Cѡ���൱�ڼ�ѹ��Dѡ���൱�ڼ�ѹ;�����ʵ��Ӧ��ֻ��һ������,ʵ��1��2ѹǿ��ͬ,�¶���ͬ;ʵ��2��3�¶Ȳ�ͬ,������ͬ;ѹǿԽ��ת����Խ��,px��ѹǿС��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣���2012?���죩����[CO��NH2��2]�����������˹��ϳɵ��л��
��1����ҵ��������CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ��
��2������̼�� =4ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��
=4ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��
��A����淴Ӧ����v����CO2�� B�������Ӧ����v����CO2��������ڡ���С�ڡ����ڡ�����
��NH3��ƽ��ת����Ϊ ��
��3���˹�����ɲ��ü�ӵ绯ѧ������ȥ��л�����е����أ�ԭ����ͼ2��ʾ��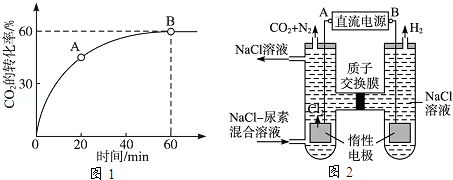
�ٵ�Դ�ĸ���Ϊ ���A����B������
���������з����ķ�Ӧ����Ϊ �� ��
�۵���������������Һ��pH����ǰ��Ƚ� �����������ռ�������13.44L����״���������ȥ������Ϊ g������������ܽ⣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ȼ�ͭ��һ�ֹ㷺�����������ϡ�ľ�ķ������ȵĻ�����Ʒ��ij�о�С���ô�ͭ��������Fe�������������Ʊ��Ȼ�ͭ���壨CuCl2��2H2O����
��1��ʵ���Ҳ�������ͼ��ʾ��װ�ã��ɽ���ͭ��Cl2��Ӧת��Ϊ����1�����������ͼг�װ������ȥ����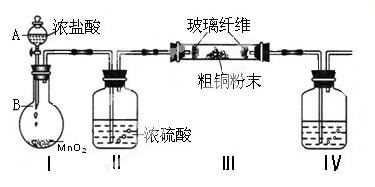
�� ����A���������������� ��
�� װ��B�з�����Ӧ�����ӷ���ʽ��������������
�����Ũ�����˳�����£����ܵ�ԭ���� ��
��װ�â���ʢװ���Լ��� ���������� ��
��2����CuCl2��Һת��ΪCuCl2��2H2O�IJ��������У�������Һ��ɫ����ɫ��Ϊ����ɫ��С��ͬѧ��̽����ԭ��
��֪�����Ȼ�ͭ��Һ��������ת����ϵ��
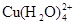 (aq) +4Cl��(aq)
(aq) +4Cl��(aq)
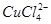 (aq) +4H2O(l)
(aq) +4H2O(l)
��ɫ������������������������ɫ
��������Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K=����������
������ʹ��Һ�ɻ�ɫ�����ɫ����д�����ֿɲ��õķ���
a�� b ��
��3����CuCl2��Һ�õ�CuCl2��2H2O�Ĺ�����Ҫ���������Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ�֡��˹��̵������·������ڳ��¡���ѹ�����������£�N2�ڴ���������ˮ������Ӧ����NH3��N2��3H2O 2NH3��
2NH3��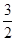 O2
O2
��һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ��±�(��Ӧʱ��3 h)��
| T/�� | 30 | 40 | 50 |
| ����NH3��/(10��6 mol) | 4.8 | 5.9 | 6.0 |
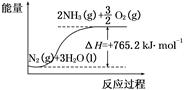
 2NH3(g) ��H����92.4 kJ/mol����ijѹǿ�㶨���ܱ������м���2 mol N2��4 mol H2���ﵽƽ��ʱ��N2��ת����Ϊ50%�������Ϊ10 L����
2NH3(g) ��H����92.4 kJ/mol����ijѹǿ�㶨���ܱ������м���2 mol N2��4 mol H2���ﵽƽ��ʱ��N2��ת����Ϊ50%�������Ϊ10 L�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�¶�ʱ����2 L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯��������ͼ��ʾ��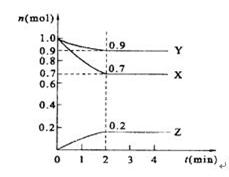
��1����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ ��
��3���ﵽƽ����X��Ũ���� ��
��4������Ӧ���е��� min���÷�Ӧ�ﵽƽ�⡣��Ӧ�ﵽƽ������д�ʩ�ܼӿ컯ѧ��Ӧ���ʵ��� ��
A������Ӧ���Ũ�� B�������¶� C��ʹ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪CO2(g)��3H2(g) CH3OH(l)��H2O(l)����H����130.9 kJ��mol��1
CH3OH(l)��H2O(l)����H����130.9 kJ��mol��1
(1)�ֽ�0.8 mol CO2��2.4 mol H2�����ݻ�Ϊ20 L���ܱ������з���������Ӧ������˵����ȷ����__________(����ĸ���)��
| A���÷�Ӧ�ڵ��������Է����� |
| B����������CO2������������㶨ʱ���÷�Ӧ�Ѵ�ƽ��״̬ |
| C���������������䣬ʵ����ƽ�ⳣ����K(T1)��K(T2)����T1��T2 |
| D�����и÷�Ӧ��X��Y���ִ�����X��ʹ����Ӧ���ʼӿ�Լ5��105����Y��ʹ�淴Ӧ���ʼӿ�Լ8��106��(����������ͬ)������������Ӧ��ѡ��XΪ���������� |

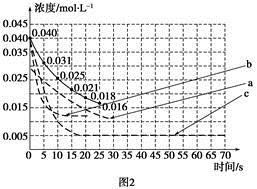
| ʵ�� ��� | CO2��ʼ Ũ��/mol��L��1 | ��Ӧ�� ��/�� | ��Ӧѹ ǿ/kPa | �Ƿ���� ���� |
| A | 0.030 | 150 | 101 | �� |
| B | 0.040 | 150 | 101 | �� |
| C | 0.040 | 250 | 101 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ܱ������н��е����·�Ӧ��2SO2(g)��O2(g) 2SO3(g)��SO2����ʼŨ����0.4 mol��L��1��O2����ʼŨ����1 mol��L��1����SO2��ת����Ϊ80%ʱ����Ӧ�ﵽƽ��״̬��
2SO3(g)��SO2����ʼŨ����0.4 mol��L��1��O2����ʼŨ����1 mol��L��1����SO2��ת����Ϊ80%ʱ����Ӧ�ﵽƽ��״̬��
(1)��Ӧ��ƽ�ⳣ��Ϊ________��
(2)����ƽ��ʱ��Ӧ������ѹǿ����1����ƽ�⽫________(�����������)�ƶ���
(3)��ƽ��ʱ��Ӧ������ѹǿ��С1����ƽ�⽫________(�����������)�ƶ���
(4)ƽ��ʱ����������䣬��ƽ���������г���ϡ������Ar��ʹ��ϵ��ѹ��Ϊԭ����3����ƽ�⽫________(�����������)�ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��A��B��C��D�ĸ���Ӧ:
| ��Ӧ | A | B | C | D |
| ��H/(kJ��mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ��S/(J��mol-1��K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1.0 L�ܱ������з���0.10 mol A(g)����һ���¶Ƚ������·�Ӧ��
A(g) B(g)��C(g)������H����85.1 kJ��mol��1
B(g)��C(g)������H����85.1 kJ��mol��1
��Ӧʱ��(t)��������������ѹǿ(p)�����ݼ��±���
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ��ѹǿp/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| ��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol��L��1) | 0.10 | a | 0.026 | 0.006 5 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com