
 (1)处于平衡状态的时间段是
(1)处于平衡状态的时间段是

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、C2H2和C2H6 |
| B、C2H2和C3H8 |
| C、CH4和C2H4 |
| D、C2H2和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、异秦皮啶与秦皮素互为同系物 |
| B、异秦皮啶分子式为C11H10O5 |
| C、鉴别异秦皮啶与秦皮素可用FeCl3溶液 |
| D、1mol的秦皮素最多可与4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B、pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性 |
| C、pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg2=0.3) |
| D、将10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 884消毒液 【有效成分}NaClO 【规格】1 000mL 【质量分数】25% 【密度】1.19g?cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
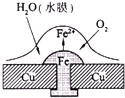 已知铅蓄电池的总反应PbO2+Pb+2H2SO4═2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4═2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A、如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 |
| B、铅蓄电池充电时,阳极电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42- |
| C、铅蓄电池放电时,电路中每转移2mol电子,消耗1mol硫酸 |
| D、铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片投入到稀硫酸中产生大量的气泡 |
| B、打开盛有浓盐酸的试剂瓶盖时,瓶口出现白雾 |
| C、汞在空气中加热生成红色粉末 |
| D、硫在氧气中燃烧产生蓝紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、4g | C、8g | D、20g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com