
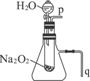
 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.分析 (1)往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,说明过氧化钠与水反应放出热量;
(2)用a图所示装置进行实验,生成氧气具有助燃性,所以可用带火星的木条在此处检验;根据放热使锥形瓶内气体膨胀分析.
解答 解:(1)脱脂棉燃烧的条件:一是有氧气(空气),二是达到其着火点,则往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,可知该反应是放热反应,
故答案为:该反应是放热反应;
(2)①用图示装置进行实验,由于产生的O2必定从p口逸出,则验证第a的结论的实验方法是P处用带火星的木条靠近木条复燃,
故答案为:将带火星的木条靠近导管口p处,木条复燃;
②反应放热必使试管外锥形瓶内的空气膨胀,故可在q处验证第二条结论,操作方法为:将导管q放入水中,反应过程中导管口有气泡冒出,
故答案为:将导管q放入水中,反应过程中导管口有气泡冒出.
点评 本题考查过氧化钠与水反应的实验,为高频考点,题目难度不大,明确发生的反应、反应特点及物质的性质为解答的关键,试题侧重考查学生的分析能力与化学实验能力.


科目:高中化学 来源: 题型:选择题
| 共价键 | 键能 |
| H-H | 436 |
| H-F | 565 |
| H-S | 339 |
| H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | B. | H(g)+F(g)→HF (g)+565kJ | ||
| C. | HF的热稳定性大于H2S | D. | H2S的沸点比H2Se的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得1.12 L O2,转移电子数目为 0.2 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
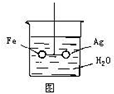 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com