
| V |
| Vm |
| n |
| c |
| 1000�Ѧ� |
| M |
| n |
| c |
| 4.48L |
| 22.4L/mol |
| 0.4mol |
| 2mol/L |
| 1000��1.043��10% |
| 36.5 |
| 0.4mol |
| 2.858mol/L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijͬѧ�����ͼװ�ã��о��ǽ���Ԫ�����ʱ仯���ɣ�
ijͬѧ�����ͼװ�ã��о��ǽ���Ԫ�����ʱ仯���ɣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 I���±���ʵ�����Ʊ�������й����ݣ�
I���±���ʵ�����Ʊ�������й����ݣ�| ��� | ʵ������ | ʵ��ԭ�� | ����װ�� |
| �� | ������ | H2O2��O2 | |
| �� | �ư��� | NH4Cl��NH3 | |
| �� | ������ | HCl��Cl2 |
| ||
| ||


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
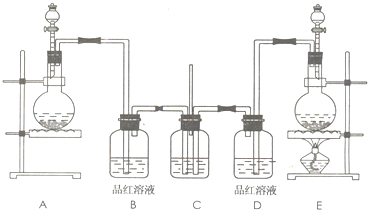
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��13�֣�A��B��C��D��E��X��YΪ��ѧ�������������ʣ�����������ת����ϵ�����ֲ����뷴Ӧ������ȥ����
��1����AΪ�������ʣ�BΪ������XΪ���ᣬYΪ����ǿ����Һ����A���ʵ������� ��D��Y��Ӧ�����ӷ���ʽΪ��
��2����AΪ����ǽ������ʣ�BΪˮ��XΪǿ�ᣬYΪ����Ԫ�صĻ������A���ʵ����ƿ����� ��D��Y��Ӧ�����ӷ���ʽΪ����Ϊ
��
��3����A��CΪͬ����Ԫ����ɵĵ��ʣ�ͨ��״���£�AΪ���壬CΪҺ�壬YΪ�������ʡ���D��Һ�� ��������ԣ�ԭ����
�������ӷ���ʽ����
��NaOH��Һ����E����Һ�У��ɹ۲쵽�������� ��
D��E�Ļ�ѧ��Ӧ����ʽΪ ��
����������1������ͼ�е�ת���ص��֪��C��ǿ�Ӧ������D�����ܽ���ǿ���У������������Ļ������ת�����ٽ��A�ǽ�����֪��A����������ġ������������Ȼ���������D������������E��ƫ�����ơ�
��2�������ǽ��������ܺ��ᷴӦ����ˮ�ģ�һ��ǿ���������C��S��Ӧ�����ɵ�CO2��SO2�����������Ʒ�Ӧ�������λ���ʽ�Ρ�
��3��������Һ�嵥�����壬A���û����壬˵��A������������ת���ص���жϣ�Y�DZ�۵Ľ�����������������Һ�д���ˮ��ƽ�⣬��Һ�����ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ӱ�ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��13�֣�A��B��C��D��E��X��YΪ��ѧ�������������ʣ�����������ת����ϵ�����ֲ����뷴Ӧ������ȥ����

��1����AΪ�������ʣ�BΪ������XΪ���ᣬYΪ����ǿ����Һ����A���ʵ������� ��D��Y��Ӧ�����ӷ���ʽΪ��
��2����AΪ����ǽ������ʣ�BΪˮ��XΪǿ�ᣬYΪ����Ԫ�صĻ������A���ʵ����ƿ����� ��D��Y��Ӧ�����ӷ���ʽΪ����Ϊ
��
��3����A��CΪͬ����Ԫ����ɵĵ��ʣ�ͨ��״���£�AΪ���壬CΪҺ�壬YΪ�������ʡ���D��Һ�� ��������ԣ�ԭ����
�������ӷ���ʽ����
��NaOH��Һ����E����Һ�У��ɹ۲쵽�������� ��
D��E�Ļ�ѧ��Ӧ����ʽΪ ��
����������1������ͼ�е�ת���ص��֪��C��ǿ�Ӧ������D�����ܽ���ǿ���У������������Ļ������ת�����ٽ��A�ǽ�����֪��A����������ġ������������Ȼ���������D������������E��ƫ�����ơ�
��2�������ǽ��������ܺ��ᷴӦ����ˮ�ģ�һ��ǿ���������C��S��Ӧ�����ɵ�CO2��SO2�����������Ʒ�Ӧ�������λ���ʽ�Ρ�
��3��������Һ�嵥�����壬A���û����壬˵��A������������ת���ص���жϣ�Y�DZ�۵Ľ�����������������Һ�д���ˮ��ƽ�⣬��Һ�����ԡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com