ЈЁ2012?№г¶«Ј©өвФЪҝЖСРУлЙъ»оЦРУРЦШТӘЧчУГЈ¬ДіРЛИӨРЎЧйУГ0.50mol?L
-1KIЎў0.2%өн·ЫИЬТәЎў0.20mol?L
-1K
2S
2O
8Ўў0.10mol?L
-1Na
2S
2O
3өИКФјБЈ¬МҪҫҝ·ҙУҰМхјю¶Ф»ҜС§·ҙУҰЛЩВКөДУ°ПмЈ®
ТСЦӘЈәS
2O
82-+2I
-=2SO
42-+I
2ЈЁВэЈ© I
2+2S
2O
32-=2I
-+S
4O
62- ЈЁҝмЈ©
ЈЁ1Ј©ПтKIЎўNa
2S
2O
3Улөн·ЫөД»мәПИЬТәЦРјУИлТ»¶ЁБҝөДK
2S
2O
8ИЬТәЈ¬өұИЬТәЦРөД
Na2S2O3
Na2S2O3
әДҫЎәуЈ¬ИЬТәСХЙ«Ҫ«УЙОЮЙ«ұдОӘА¶Й«Ј¬ОӘИ·ұЈДЬ№ЫІмөҪА¶Й«Ј¬S
2O
32-УлS
2O
82-іхКјөДОпЦКөДБҝРиВъЧгөД№ШПөОӘЈәnЈЁS
2O
32-Ј©ЈәnЈЁS
2O
82-Ј©
Јј2
Јј2
Ј®
ЈЁ2Ј©ОӘМҪҫҝ·ҙУҰОпЕЁ¶И¶Ф»ҜС§·ҙУҰЛЩВКөДУ°ПмЈ¬ЙијЖөДКөСй·Ҫ°ёИзПВұнЈә
КөСй
РтәЕ |
Ме»эV/ml |
| K2S2O8ИЬТә |
Л® |
KIИЬТә |
Na2S2O3ИЬТә |
өн·ЫИЬТә |
| ўЩ |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ўЪ |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ўЫ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
ұнЦРVx=
2
2
mlЈ¬АнУЙКЗ
ұЈЦӨЖдЛыМхјюІ»ұдЈ¬Ц»ёДұд·ҙУҰОпK2S2O8ЕЁ¶ИЈ¬ҙУ¶шІЕөҪҙп¶ФХХКөСйДҝөД
ұЈЦӨЖдЛыМхјюІ»ұдЈ¬Ц»ёДұд·ҙУҰОпK2S2O8ЕЁ¶ИЈ¬ҙУ¶шІЕөҪҙп¶ФХХКөСйДҝөД
Ј®
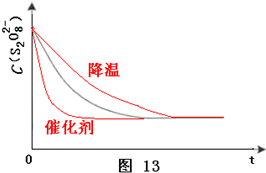
ЈЁ3Ј©ТСЦӘДіМхјюПВЈ¬ЕЁ¶ИcЈЁS
2O
82-Ј©Ў«·ҙУҰКұјдtөДұд»ҜЗъПЯИзНј13Ј¬ИфұЈіЦЖдЛьМхјюІ»ұдЈ¬ЗлФЪҙрМвҝЁЧшұкНјЦРЈ¬·Цұр»ӯіцҪөөН·ҙУҰОВ¶ИәНјУИлҙЯ»ҜјБКұcЈЁS
2O
82-Ј©Ў«·ҙУҰКұјдtөДұд»ҜЗъПЯКҫТвНјЈЁҪшРРПаУҰөДұкЧўЈ©Ј®

ЈЁ4Ј©өвТІҝЙУГЧчРДФаЖрІ¶ЖчөзФҙ-п®өвөзіШөДІДБПЈ¬ёГөзіШ·ҙУҰОӘЈә2LiЈЁsЈ©+I
2 ЈЁsЈ©=2LiIЈЁsЈ©ЎчH
ТСЦӘЈә4LiЈЁsЈ©+O
2 ЈЁgЈ©=2Li
2OЈЁsЈ©ЎчH
14LiIЈЁsЈ©+O
2 ЈЁgЈ©=2I
2 ЈЁsЈ©+2Li
2OЈЁsЈ©ЎчH
2ФтөзіШ·ҙУҰөДЎчH=
Ј»өвөзј«ЧчОӘёГөзіШөД
Хэ
Хэ
ј«Ј®


 Ј»
Ј»

 ҝЖС§КөСй»о¶ҜІбПөБРҙр°ё
ҝЖС§КөСй»о¶ҜІбПөБРҙр°ё