Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)

Ni(CO)
4(g) 该反应的△H
<
<
0 (选填“>”或“=”或“<”).
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O
2(g)=CO
2(g)△H
1=-393.5kJ?mol
-1CO
2(g)+C(s)=2CO(g)△H
2=+172.5kJ?mol
-1S(s)+O
2(g)=SO
2(g)△H
3=-296.0kJ?mol
-1请写出CO除SO
2的热化学方程式
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
2CO(g)+SO2(g)=S(s)+2CO2(g)△H3=-270kJ?mol-1
.
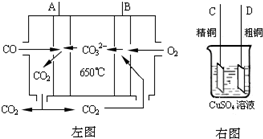
(3)如图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li
2CO
3和Na
2CO
3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.回答下列问题:
①写出A极发生的电极反应式
CO-2e-+CO32-=2CO2
CO-2e-+CO32-=2CO2
.
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与
D
D
极 (填:“C”或“D”)相连.
③当消耗2.24L(标况下)CO时,粗铜电极理论上减少铜的质量
小于
小于
(填:“大于”、“等于”或“小于”)6.4克.
Ⅱ.(1)已知Na
2CrO
4溶液酸化时发生的反应为:2CrO
42-+2H
+?Cr
2O
72-+H
2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55mol,CrO
42-有
转化为Cr
2O
72-.又知:常温时该反应的平衡常数K=10
14.上述酸化后所得溶液的pH=
6
6
.
(2)根据有关国家标准,含CrO
42-的废水要经化学处理,使其浓度降至5.0×10
-7mol?L
-1以下才能排放.含CrO
42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO
4沉淀[K
sp(BaCrO
4)=1.2×10
-10],再加入可溶性硫酸盐处理多余的Ba
2+.加入可溶性钡盐后的废水中Ba
2+的浓度应不小于
2.4×10-4
2.4×10-4
mol?L
-1,然后再进行后续处理方能达到国家排放标准.
②还原法:CrO
42-Cr
3+Cr(OH)
3.用该方法处理10m
3 CrO
42-的物质的量浓度为1.0×10
-3 mol?L
-1的废水,至少需要绿矾(FeSO
4?7H
2O,相对分子质量为278)
8.34
8.34
Kg(保留两位小数).

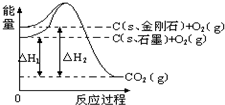 图中△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,有关说法正确的是( )
图中△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,有关说法正确的是( )

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
 CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.