
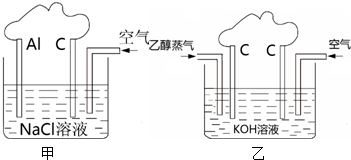
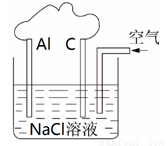
 利用铝与空气中的氧气发生反应,利用如图甲可设计为原电池,实现化学能转化为电能.
利用铝与空气中的氧气发生反应,利用如图甲可设计为原电池,实现化学能转化为电能.
| ||
| ||
 ,
, .
.

科目:高中化学 来源: 题型:阅读理解
| 无水AlCl3 |
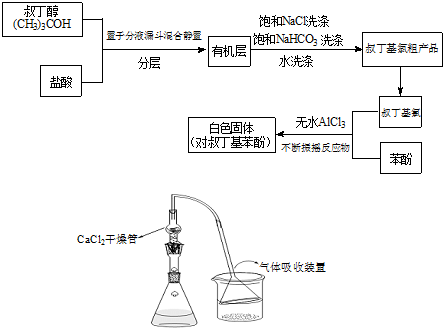
 +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
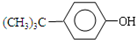 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl查看答案和解析>>
科目:高中化学 来源: 题型:
 铁、铜和铝是人类生活中常用的金属.
铁、铜和铝是人类生活中常用的金属.查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)利用铝与空气中的氧气发生反应,可设计为原电池,实现化学能转化为电能。
(1)回答下列问题:
①写出铝与空气反应的化学方程式 ,
②Al片上发生的电极反应式是 ,
③石墨棒上发生的电极反应式是 ,
④消耗27g铝时,转移的电子数为 mol。
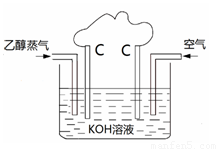
(2)25℃、101kPa乙醇的燃烧热为1366.8kJ•mol-1。
①写出该反应的热化学方程式: 。
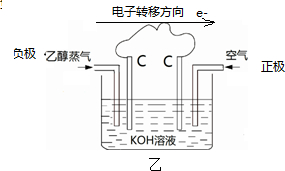
②利用该反应设计如图所示的原电池,在图中适当
的位置标出该电池的正、负极及电子转移的方向。
查看答案和解析>>
科目:高中化学 来源:2012届广东省广州市七区联考高二下学期期末教学质量监测化学试卷 题型:综合题
(10分)利用铝与空气中的氧气发生反应,可设计为原电池,实现化学能转化为电能。
(1)回答下列问题:
①写出铝与空气反应的化学方程式 ,
②Al片上发生的电极反应式是 ,[来源:ZXXK]
③石墨棒上发生的电极反应式是 ,
④消耗27g铝时,转移的电子数为 mol。
(2)25℃、101kPa乙醇的燃烧热为1366.8kJ•mol -1。
①写出该反应的热化学方程式: 。
②利用该反应设计如图所示的原电池,在图中适当
的位置标出该电池的正、负极及电子转移的方向。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com