
 .
. 分析 (1)根据化学键的成键特点和分类判断,金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键;
(2)同素异形体:同种元素组成的不同单质;同位素:质子数相同中子数不同的同一元素的原子互称同位素;
(3)MgCl2为离子化合物,根据离子化合物的电子式表示方法写出氯化镁的形成过程.
解答 解:(1)①Ne为单原子分子,不存在化学键;
②NH4Cl为离子化合物,含有离子键和极性共价键;
③CaO为离子化合物,只含有离子键;
④HNO3为共价化合物,只含有极性共价键;
⑤Na2O2为离子化合物,含有离子键和非极性共价键;
⑥KOH为离子化合物,含有离子键和极性共价键;
⑦MgCl2为离子化合物,只含有离子键;
⑧CO2为共价化合物,只含有极性共价键,
故答案为:④⑧;③⑦;②⑥;⑤;
(2)O2、O3同种元素组成的不同单质,互为同素异形体;②${\;}_{17}^{35}$Cl⑥${\;}_{17}^{37}$Cl的质子数相同、中子数不同,互称同位素,①液氨、④氨气为氨气的不同聚集状态,为同一种物质,
故答案为:③;⑤;②;⑥;①;④;
(3)镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为: ;
;
故答案为: .
.
点评 本题考查较为综合,涉及化学键的类型、同位素、同素异形体的识别以及电子式的书写,为高频考点,题目难度不大,注意离子键与共价键的区别以及电子式的书写方法.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
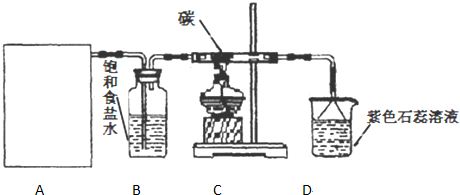
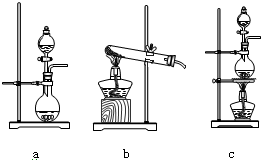
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | 稳定性:H2Se>AsH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
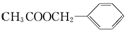 )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.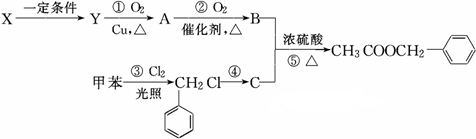
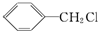 发生反应④的化学方程式为
发生反应④的化学方程式为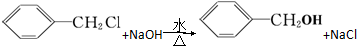 ,该反应的反应类型为水解反应.
,该反应的反应类型为水解反应.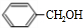 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$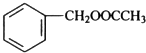 +H2O.
+H2O.查看答案和解析>>
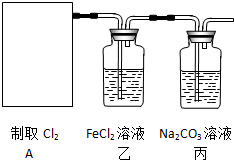
科目:高中化学 来源: 题型:多选题
| A. | 为了加快反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 反应中不需加碎瓷片作沸石 | |
| D. | 为了除去杂质气体,除了用硫酸铜外还可用氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中阴、阳离子的半径比 | B. | 离子晶体的晶格能 | ||
| C. | 晶体中阴、阳离子的电荷比 | D. | 离子键的纯粹程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com