
 |  |  |  |
| A.吸收氨气 | B.中和热的测定 | C.分离溴苯和苯的混合物 | D.除去SO2气体中的HCl |
| A. | A | B. | B | C. | C | D. | D |
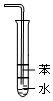
分析 A.该装置无法防止倒吸,应该用四氯化碳;
B.图示装置中温度计的位置错误;
C.蒸馏操作需要加热,该装置缺少加热装置;
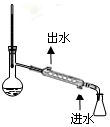
D.氯化氢与亚硫酸氢钠反应,而二氧化硫不反应.
解答 解:A.氨气极易溶于水,吸收氨气时需要防止倒吸,该装置无法达到实验目的,可以将苯换成四氯化碳溶液,故A错误;
B.温度计测定温度,环形玻璃搅拌棒可搅拌,泡沫可隔热,温度计应在搅拌棒的中央,图中的实验装置不合理,故B错误;
C.分离溴苯和苯的混合物操作为蒸馏,图示装置中缺少酒精灯,无法达到实验目的,故C错误;
D.HCl与亚硫酸氢钠溶液反应,而二氧化硫不与亚硫酸氢钠反应,可提高图示洗气装置除去SO2气体中的HCl,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,涉及尾气吸收、中和热测定、物质分离与提纯等知识,明确常见化学实验基本操作方法即可解答,试题有利于提高学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 当混合溶液的pH>7时,其中不可能存在HAc分子 | |
| B. | 当混合溶液的pH<7时,混合液中c(Na+)>c((Ac-) | |
| C. | 判断该滴定过程的终点,最好选择甲基橙作为指示剂 | |
| D. | 达到滴定终点时,混合液中c(Na+)和c((Ac-)一定不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Al(OH)3治疗胃酸过多 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用金属铝进行铝热法炼铁 | D. | 用水玻璃制备硅胶和木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
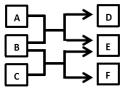 X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1D溶液的pH为13(25℃).它们满足如图转化关系,则下列说法正确的是( )| A. | 由X、Y、Z、W四种元素组成的盐溶液pH小于7 | |
| B. | 化合物F中含有共价键和离子键 | |
| C. | 0.1molB与足量C完全反应共转移电子数为0.2NA | |
| D. | Z元素的最高正价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
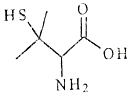
| A. | X的分子式为C5H10NO2S | |
| B. | X有2个手性碳原子 | |
| C. | X能发生加聚反应生成高分子化合物 | |
| D. | X既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol蔗糖完全水解生成葡萄糖分子数为2 NA | |
| B. | 在氢氧碱性燃料电池中,若正极消耗22.4L气体(标准状况),则转移电子数为2NA | |
| C. | 16.0 gCuO和Cu2S的混合物含阴离子数为0.2NA | |
| D. | 2.24L(标准状况)一氯甲烷分子中含共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
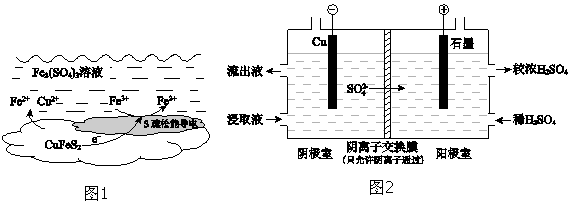
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com