

分析 (1)铝在空气中能被氧化氧化生成致密的氧化膜;
(2)铝和氧化铁在高温条件下发生铝热反应生成氧化铝和铁;
(3)①根据影响反应速率的因素判断;
②铁和盐酸产生氢气,根据氢气的体积可求得盐酸的浓度变化,根据v=$\frac{△c}{△t}$计算反应速率;
③铁和盐酸产生氢气,是放热反应,根据影响反应速率的因素分析答题.
解答 解:(1)铝常温下与氧气反应,表面形成致密的氧化膜,所以铝在空气中能稳定存在,
故答案为:铝常温下与氧气反应,表面形成致密的氧化膜;
(2)铝和氧化铁在高温条件下发生铝热反应生成氧化铝和铁,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ Al2O3+2 Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ Al2O3+2 Fe;
(3)①甲、乙注射器内放入的铁和铝的质量相等,但两种金属的形状不同,铁丝的表面积要比铝片的大,表面积越大,反应速率越大,所以会造成实验结果跟理论不符的现象,
故答案为:铁丝与铝片的表面积不相同;
②铁和盐酸产生氢气,产生H2 67.2mL即0.003mol,消耗盐酸的物质的量为0.006mol,所以盐酸的浓度变化为$\frac{0.006mol}{3.0×1{0}^{-2}L}$=0.2mol/L,所以平均反应速率=$\frac{△c}{△t}$=$\frac{0.2mol/L}{2min}$=0.10 mol.L-1.min-1,
故答案为:0.10 mol.L-1.min-1;
③铁和盐酸产生氢气,是放热反应,会使反应体系温度升高,温度越高反应速率越大,随着反应的进行,反应物盐酸的浓度会下降,反应速率下降,所以产生H2的速率呈现先增大、后减缓的趋势,
故答案为:反应放热使体系温度升高;盐酸浓度降低.
点评 本题考查了化学反应速率的影响因素,外界条件影响化学反应速率,但决定化学反应速率的是物质本身的性质,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
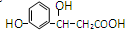 ,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )| A. | ①⑤⑧ | B. | ①②⑤⑨ | C. | ②⑥⑧⑨ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①用砂纸摩擦后的镁带与沸水反应,再向反应 应后溶液中滴加酚酞 | A、浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 |
| ②钠与滴有酚酞试液的冷水反应 | B、产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③镁条与2mol•L-1的盐酸反应 | C、反应不十分强烈,产生无色气体 |
| ④铝条与2mol•L-1的盐酸反应 | D、剧烈反应,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E、生成白色胶状沉淀,继而沉淀消失 |
| 实验方案 | 实验现象(填写序号) |
| ① | B |
| ② | A |
| ③ | D |
| ④ | C |
| ⑤ | E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛,然后再用稀NaOH溶液冲洗 | |
| C. | 酒精着火时可用水扑灭 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com