
A、SiO2+CaCO3
| ||||
B、3Mg+2NH3
| ||||
C、Fe3O4+4CO
| ||||
| D、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |
科目:高中化学 来源: 题型:
| A、K+、AlO2-、OH-、Na+ |
| B、Na+、H+、CO32-、SO42- |
| C、K+、H+、SiO32-、Cl- |
| D、OH-、Na+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、H+、Cl-、SCN- |
| B、Fe2+、SO42-、H+、NO3- |
| C、Ca2+、HCO3-、Cl-、Na+ |
| D、K+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B、过量的SO2通入澄清石灰水中:Ca2++2OH-+SO2=CaSO3↓+H2O |
| C、盐酸与硅酸钠溶液混合:2H++SiO32-=H2SiO3↓ |
| D、硫酸铝溶液中加入到过量的烧碱中:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4比BaCO3溶解度小,所以,BaCO3不可能转化为BaSO4 | ||
| B、BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | ||
C、任何温度下,向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,
| ||
| D、该温度下,BaCO3若要在Na2SO4溶液中转化为BaSO4,则Na2SO4浓度至少为2.2×10-6mol?L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 3 |
| 2 |
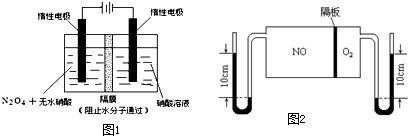
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮的单质和化合物在工农业生产中有着广泛的应用.
氮的单质和化合物在工农业生产中有着广泛的应用.
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com