

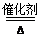 4NO+6H2O 有红棕色气体生成
4NO+6H2O 有红棕色气体生成

科目:高中化学 来源:不详 题型:单选题
| A.实验室制取氨气的发生装置与用高锰酸钾制取氧气的装置相同 |
| B.并不是所有的铵盐都能与烧碱共热生成氨气 |
| C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO |
| D.CO2、NO2、P2O5均与水反应生成酸为酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
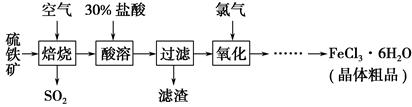
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
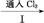 低浓度 Br2
低浓度 Br2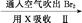 含Br-等的溶液
含Br-等的溶液 Br2的浓溶液
Br2的浓溶液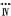 液溴
液溴 2Cl-+Br2
2Cl-+Br2查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性 |
| B.铜银都能与稀硝酸反应,收集到的V L气体全为NO |
| C.操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干 |
| D.根据反应收集到的气体体积可以计算铜和银的质量分数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

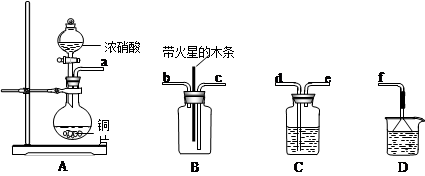
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com