

| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,体积) | 1.12 | 2.24 | 3.36 | 4.48 |
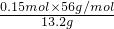 ×100%=63.6%;
×100%=63.6%;

科目:高中化学 来源: 题型:

| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,体积) | 1.12 | 2.24 | 3.36 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验目的:鉴定该种茅草的根是否含有还原性糖和淀粉。
(2)实验原理:还原性糖可用______来检测,淀粉可用______来检测。
(3)实验器材:该种茅草的根、所需试剂、刀片、载玻片、酒精灯、试管夹、火柴、滴管。
(4)实验步骤:
①鉴定还原性糖:________________________________。
②鉴定淀粉:____________________________________。
(5)实验现象:________________________________________________________。
(6)结果分析:________________________________________________________。
(7)在鉴定还原性糖的实验操作中注意:__________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届陕西省岐山县高三上学期期中质量检测化学试卷(解析版) 题型:实验题
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。

请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
|
实验编号 |
① |
② |
③ |
④ |
|
稀HNO3体积(mL) |
100 |
200 |
300 |
400 |
|
剩余金属质量(g) |
9.0 |
4.8 |
0 |
0 |
|
NO体积(L,标况) |
1.12 |
2.24 |
3.36 |
4.48 |
①实验①最先溶解的金属发生反应的化学方程式是 。
②滤渣B中Fe的质量分数为____%(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省大连二十四中高三(上)期中化学试卷(解析版) 题型:解答题

| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | ||
| NO体积(L,体积) | 1.12 | 2.24 | 3.36 | 4.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com