
| A. | 氯水 | B. | 硫酸 | C. | 硝酸锌 | D. | 硝酸 |
科目:高中化学 来源: 题型:实验题
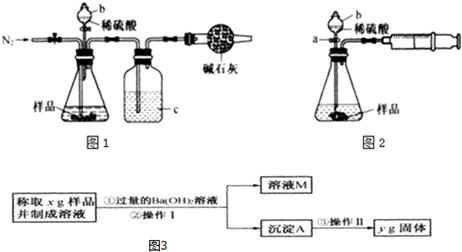
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的熔沸点依次升高 | |
| B. | 乙醇分子与水分子之间只存在范德华力 | |
| C. | 甲醇的熔点、沸点大于甲烷是由于甲醇分子之间存在氢键 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 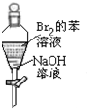 充分振荡后静置,上层溶液颜色保持不变 | |
| B. | 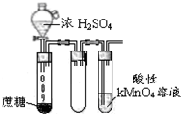 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 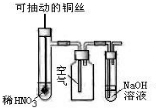 微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 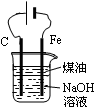 制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
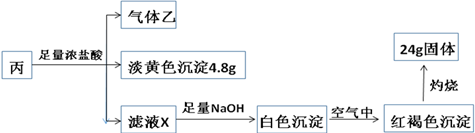
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
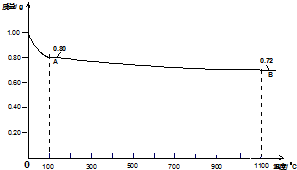
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
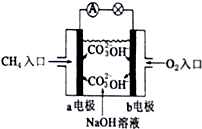 燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图.按要求完成下列问题:
燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图.按要求完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学是指利用化学原理对已产生的环境污染进行治理 | |
| B. | 视频《苍穹之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 离子键、共价键和氢键等化学键都可能对物质的熔沸点产生影响 | |
| D. | 高分子膜在分离提纯、物质制备以及能量转化等领域都有广泛应用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com