
 3C(g)��
3C(g)��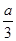 ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3�Ѵﵽƽ��״̬�� ��
2NH3�Ѵﵽƽ��״̬�� ��| A��1mol N��N���Ͽ���ͬʱ�� ��6 mol H-N������ |
| B��1 mol N��N���Ͽ���ͬʱ�� ��6 mol H-N���Ͽ� |
| C��1 mol N��N�����ɵ�ͬʱ�� ��3 mol H-H������ |
| D��1 mol N��N���Ͽ���ͬʱ�� ��3 mol H-H���Ͽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �� | X | Y | W |
| n����ʼ״̬��/mol | 2 | 1 | 0 |
| n��ƽ��״̬��/mol | 1 | 0.5 | 1.5 |
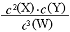
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g) + H2O(g) ��ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g) ��ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
 ��ʱ�����ķ�Ӧ�������淴Ӧ���ʵĹ�ϵʽ�� ������ţ���
��ʱ�����ķ�Ӧ�������淴Ӧ���ʵĹ�ϵʽ�� ������ţ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
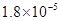 ��Ka��HSCN����0.13�����ܵ���ʵ��ܶȻ�������Kap��CaF2����
��Ka��HSCN����0.13�����ܵ���ʵ��ܶȻ�������Kap��CaF2����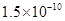
 mol��L-1�����ˮ��Һ�У�������ҺpH����������仯�����õ�c��HF����c��F-������ҺpH�ı仯��ϵ������ͼ��ʾ��
mol��L-1�����ˮ��Һ�У�������ҺpH����������仯�����õ�c��HF����c��F-������ҺpH�ı仯��ϵ������ͼ��ʾ��

 mol��L-1HF��Һ��
mol��L-1HF��Һ��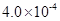 mol��L-1 CaCl2��Һ�������ϣ����ڻ��ҺpHΪ4.0�����Ե��ڻ��Һ����ı仯���� ����С����ޡ�������������
mol��L-1 CaCl2��Һ�������ϣ����ڻ��ҺpHΪ4.0�����Ե��ڻ��Һ����ı仯���� ����С����ޡ�������������| A��NH4Cl | B��NH4SCN? | C��CH3COONH4 | D��NH4HCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 b B��g����c C��g������ƽ������¶Ȳ��䣬�������������Ϊԭ����һ�������ﵽ�µ�ƽ��ʱ��c(A)��Ϊԭƽ���40%������˵����ȷ����
b B��g����c C��g������ƽ������¶Ȳ��䣬�������������Ϊԭ����һ�������ﵽ�µ�ƽ��ʱ��c(A)��Ϊԭƽ���40%������˵����ȷ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2O(g) + CO(g)����Ӧ�������¶���ͬ������ʼŨ�Ȳ�ͬ������ �ף�n(CO2)��n(H2)��1 mol;�ң�n(CO2)��1 mol, n(H2)��2mol������n(CO2)��n(H2)��1mol n[H2O(g)]��1 mol.�ﵽƽ��ʱCO�����ʵ����ɴ�С��˳����( )
H2O(g) + CO(g)����Ӧ�������¶���ͬ������ʼŨ�Ȳ�ͬ������ �ף�n(CO2)��n(H2)��1 mol;�ң�n(CO2)��1 mol, n(H2)��2mol������n(CO2)��n(H2)��1mol n[H2O(g)]��1 mol.�ﵽƽ��ʱCO�����ʵ����ɴ�С��˳����( )| A���ң��ף��� | B���ף������� | C���ң������� | D���ף��ң��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3( g ) �� �� H =��QkJ��mol-1
2SO3( g ) �� �� H =��QkJ��mol-1| ���� | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ��mol-1) |
| �� | 2 | 1 | 0 | Q1 |
| �� | 1 | 0.5 | 0 | Q2 |
| �� | 1 | 0.5 | 1 | Q3 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com