

分析 原料锰粉粗品的主要成分为MnO2和碳,焙烧时碳被MnO2氧化为一氧化碳,碳把二氧化锰还原为一氧化锰,应氢气还原一氧化锰得到锰单质,从流程看,还有铁单质;加入硫酸生成硫酸锰、硫酸亚铁和氢气,碳不反应,过滤除去不溶性物质如碳等,滤液中含亚铁离子、锰离子.由题给离子沉淀PH可知,除亚铁离子,需先用氧化剂氧化亚铁离子变成铁离子,再调节PH使铁离子沉淀,而锰离子不沉淀,过滤后滤液中含锰离子,加入碳酸氢铵得到碳酸锰沉淀,过滤洗涤干燥得成品碳酸锰,
(1)电池外壳锌皮与硫酸反应可以生成氢气;
(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;
(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,根据形成沉淀的pH范围分析;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子.
解答 解:(1)锌锰废电池的负极为锌,即电池外壳锌皮,锌与硫酸反应可以生成氢气,则流程中氢气的来源为:用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物,
故答案为:用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物;
(2)已知:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-174.6kJmol-1 ①,
C(s)+CO2(g)═2CO(g)△H=+283kJmol-1 ②
由盖斯定律:(①+②)×$\frac{1}{2}$得 MnO2(s)+C(s)=MnO(s)+CO(g)△H=(-174.6+283)×$\frac{1}{2}$=+54.2kJ•mol-1;
故答案为:MnO2(s)+C(s)=MnO(s)+CO(g)△H=+54.2kJ•mol-1;
(3)该流程的目的是制取碳酸锰,向MnSO4的母液中加入足量NH4HCO3,反应生成碳酸锰之外,还会生成二氧化碳和水,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
故答案为:MnCO3↓;H2O;CO2↑;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,可以用H2O2,其还原产物为水不会引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,已知离子沉淀时的pH范围:Fe3+:2.7-3.7,Mn2+:8.6-10.1,则调节pH为3.7~8.6之间,使Fe3+完全沉淀,而Mn2+不沉淀;
故答案为:H2O2;3.7~8.6;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子,其电极方程式为:Mn2++2H2O-2e-=MnO2+4H+;
故答案为:Mn2++2H2O-2e-=MnO2+4H+.
点评 本题考查了物质制备方案设计,题目涉及盖斯定律的应用、离子方程式的书写、电极反应式的书写、氧化剂的选择等知识,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
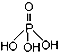 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 碳酸钾溶液与稀硫酸反应:CO32-+H+═CO2↑+H2O | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 实验室制取氧气:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2K++2Cl-+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2+2 HCL═Mg CL2+2 H2O | B. | 2 NaOH+H2SO4═Na2SO4+2 H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4+2 H2O | D. | 2 HCL+Cu(OH)2═CuCL2+2 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com