
科目:高中化学 来源: 题型:
(2009?龙岩一模)(改编)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其Ksp=[An+]m?[Bm-]n,称为难溶电解质的溶度积.25℃时,向AgCl的白色悬浊液中依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀.已知有关物质的颜色和溶度积如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
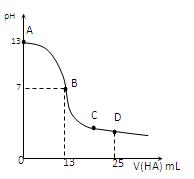
(1)写出MOH的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;
此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点_____________ _;C点___ __________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省三明一中、二中高二上学期期末联考化学试卷(带解析) 题型:填空题
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期期中考化学卷(解析版) 题型:填空题
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:

(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省高三一模考试(理综)化学部分 题型:填空题
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
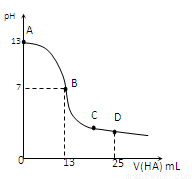
(1)写出MOH的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;
此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点_____________ _;C点___ __________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com