
【题目】下列化学用语书写正确的是( )
A.氯离子的结构示意图: ![]()
B.作为相对原子质量测定标准的碳核素: ![]() C
C
C.氯化镁的电子式: ![]()
D.用电子式表示氯化氢分子的形成过程: ![]() +
+ ![]() →
→ ![]()
【答案】C
【解析】解:A.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为: 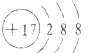 ,故A错误; B.C﹣12是作为相对原子质量测定标准的碳核素,正确表示方法为:612C,故B错误;
,故A错误; B.C﹣12是作为相对原子质量测定标准的碳核素,正确表示方法为:612C,故B错误;
C.氯化镁为离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化镁正确的电子式为: ![]() ,故C正确;
,故C正确;
D.氯化氢属于共价化合物,氯化氢的电子式中不能标出电荷,用电子式表示氯化氢的形成过程为: ![]() ,故D错误;
,故D错误;
故选C.
A.氯离子的核电荷数为17;
B.作为相对原子质量测定标准的碳核素为C﹣12;
C.氯化镁属于离子化合物,其电子式需要标出所带电荷,氯离子还需要标出最外层电子;
D.氯化氢为共价化合物,分子中不存在阴阳离子.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】工业上以1,3﹣丁二烯,丙烯,乙炔等为原料合成 ![]() 流程图如图
流程图如图 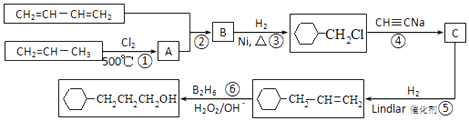
(1)反应①的反应类型是 , B中含有的官能团的名称 .
(2)写出反应②的化学方程式 .
(3)写出C的结构简式 .
(4)写出 ![]() 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式 .
(5)根据以上合成信息,以乙烯为原料合成1,6﹣己二醇,其他试剂任选,写出合成的流程图 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,正确的是( )
A. 硝酸应该保存在无色的试剂瓶中
B. 新制的氯水通常保存在无色试剂瓶中
C. 氢氧化钠溶液保存在有玻璃塞的玻璃试剂瓶中
D. 氢氟酸保存在塑料瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以采用热还原法制备金属镁(镁沸点为1107℃,熔点是648.8℃)。
(1)将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先升温至500℃保持一段时间,然后升温至1450℃反应制得镁。
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是。
②焦炭与碱式碳酸镁的物质的量的比值不同对镁的还原率有较大影响,结果如图。当比值大于15∶1时,还原率下降的原因可能是。
③碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学反应方程式。

(2)工业上可以采用MgCl2溶液和Na2CO3溶液混合制备碱式碳酸镁,写出反应离子方程式。反应采用68℃,温度不宜高于68℃的原因是。
(3)工业采用电解MgCl2溶液产生Mg(OH)2 , 如图。然后用Mg(OH)2悬浊液吸收烟气中的二氧化碳,减少二氧化碳的排放同时产生碱式碳酸镁。该电池的阴极电极反应式为。电解时还得到副产物为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘(ICl)的化学性质跟Cl2相似,预计它与H2O反应的最初生成物是
A.HI和HClOB.HCl和HIOC.HClO3和HIOD.HCl和HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法: ①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7molL﹣1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+ , 同时产生一种无色无味的气体,写出该反应的离子方程式。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为 。
(4)Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.10gT2O含有的电子数为5NA
B.常温下,0.2L 0.5molL﹣1NH4NO3溶液的氮原子数小于0.2NA
C.用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA
D.常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与硫酸型酸雨的形成无关的是( )
A.工业上大量含硫燃料的燃烧
B.工业生产使空气中CO2含量增加
C.SO2在尘埃催化下氧化为SO3
D.SO3与水反应生成H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com