
【题目】下列变化过程一定属于还原反应的是( )
A.HCl→MgCl2
B.Na→Na+
C.CO→CO2
D.Fe3+→Fe2+
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】无水氯化铝是常用的有机化工试剂,易水解、易升华。实验室用以下装置制取少量氯化铝,反应原理为2Al+6HCl(g) ![]() 2AlCl3+3H2。以下说法正确的是
2AlCl3+3H2。以下说法正确的是
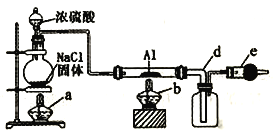
A. 圆底烧瓶中发生反应:NaCl+H2SO4(浓) ![]() HCl↑+NaHSO4
HCl↑+NaHSO4
B. 粗导管d也可换成细导管
C. e中试剂可选用碱石灰、无水氧化钙或五氧化二磷
D. 为了减少HCl的浪费,实验开始时先点燃b处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
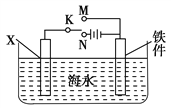
①开关K断开时,且若为生铁,则铁件主要发生_____腐蚀;若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜(含锌等杂质),容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加127 g时,X电极溶解的铜的质量________127 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,某pH=2的HCl溶液中,由水电离的c(H+)为( )
A. 1.0×10-12mol·L-1 B. 1.0×10-7mol·L-1 C. 1.0×10-10mol·L-1 D. 1.0×10-2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com