
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。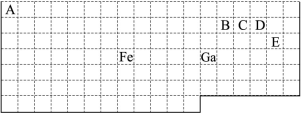
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
(1)4s24p1 (2)d 0 N2 CN- (3)CH4、CH3OH (4)正四面体 CO2、NCl3、CCl4(任写2种即可)
解析试题分析:(1)31号元素Ga原子基态的最外层电子排布式为4s24p1。(2)26号元素Fe元素在周期表的位于第四周期第Ⅷ族,位于周期表的d区。Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为0价。与CO分子互为等电子体的分子是N2,离子为CN-。(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有CH4、CH3OH;CO2中的C原子的杂化方式为sp杂化。(4)根据表格中各种元素的相对位置可以看出:A是H;B是C;C是N;D是O;E是Cl。根据VSEPR理论预测ClO4-离子的空间构型为正四面体型。在C、N、O、Cl原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有CO2、NCl3、CCl4,其电子式为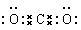 ;
; ;
;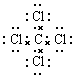 。
。
考点:考查元素的推断、元素在周期表中的位置、原子的杂化、等电子体、微粒的空间构型、分子式、电子式、电子排布式等化学用语的知识。


科目:高中化学 来源: 题型:填空题
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X是元素周期表中原子半径最小的元素,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。 请回答下列问题:
(1)Y在元素周期表中的位置为 ,ZX的电子式为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作消毒剂的有 、 (写出其中两种物质的化学式)。
(4)X2M的标准燃烧热ΔH=-a kJ·mol-1,写出表示X2M标准燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
位于短周期的四种元素A、B、C、D,其原子序数依次增大。A在周期表中原子半径
最小;B是地壳中含量最高的元素;B、D位于同一主族;C的原子半径在同周期中最大。回答下列问题:
(1)写出由上述元素形成的具有漂白作用的3种物质的化学式: 、 、 。
(2)写出含B元素质量分数最高的化合物的电子式: 。
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,试写出该反应的离子方程式: 。
(4)用电子式表示化合物C2B的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | ② | ③ | |
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分 子X,X的水溶液呈碱性 |
| D | 其简单阳离子与X具有相同电子数,且是同周 期中简单阳离子中半径最小的 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)可正确表示原子轨道的是 。
| A.2s | B.2d | C.2px | D.3f |
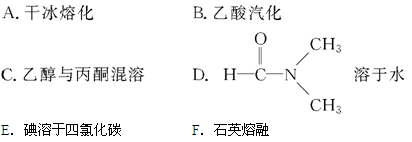
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.已知几种元素原子的价电子构型为3s2,4s2,4s24p1,3d54s2,3s23p3,它们分别属于第几周期?第几族?最高化合价是多少?各元素符号分别是什么?
Ⅱ.第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数依次增大。已知A与B 的次外层电子数均为8,而C与D的次外层电子数均为18。根据原子结构,判断:
(1)A、B、C、D的元素符号分别是________、________、________、________。
(2)写出D与A的简单离子的电子排布式________,________。
(3)哪一种元素的氢氧化物碱性最强?__________________________________________。
(4)B与D两原子间能形成何种化合物?________________。写出化学式及电子式________________,________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com