
【题目】某同学用已知物质的量浓度的NaOH测定未知物质的量浓度的盐酸,将20.00 ![]() 待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
实验编号 |
| 滴定完成时, | 待测盐酸的体积/ |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
① 滴定达到终点的标志是____________________________。
② 根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
③ 排除碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A. 滴定终点读数时俯视
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 称量的![]() 固体中混有
固体中混有![]() 固体
固体
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
【答案】 当最后一滴标准液滴入锥形瓶,溶液颜色由无色变为红色,半分钟内不褪色 0.11 丙 DE
【解析】①酚酞溶液滴加到待测的盐酸中,溶液呈无色,所以滴定终点的标志是当滴入最后一滴NaOH标准液,锥形瓶内溶液的颜色由无色变为红色,且在半分钟内不褪色;
②滴定终点时盐酸和NaOH恰好完全反应,即n(HCl)= n(NaOH),三次实验所用NaOH溶液体积的平均值为22.71mL,则0.10mol/L×22.71×10-3L=c(HCl)×20.00×10-3L,c(HCl)≈0.11mol/L;
③碱式滴定管排除尖嘴处气泡的正确方法是用如图所示操作中的丙;
④A、滴定终点读数时俯视,使读数偏小,即标准液体积减小,测定结果偏低;B、酸式滴定管使用前,水洗后未用待测盐酸润洗,使盐酸浓度减小,导致需要的标准NaOH溶液体积减小,使测定结果偏低;C、锥形瓶水洗后未干燥,不影响测定结果;D、称量等质量的NaOH和Na2CO3配成等体积的溶液时,Na2CO3溶液的浓度小,所以与等物质的量盐酸完全反应时,需要Na2CO3溶液的体积大于NaOH溶液的体积,所以当NaOH固体中混有Na2CO3固体时,使所需标准液的体积增大,测定结果偏高;E、碱式滴定管装的是标准液,开始尖嘴部分有气泡,滴定后消失,导致滴定管内液面下降,标准液体积增大,使测定结果偏高。故正确选项为DE。


科目:高中化学 来源: 题型:
【题目】下列各物质中所含氢原子个数与3.2g O2 所含的分子数相同的是( )
A. 0.2gNH3 B. 0.1mol HCl分子
C. 6.02×1023个H2SO4分子 D. 标准状况下1.12L CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
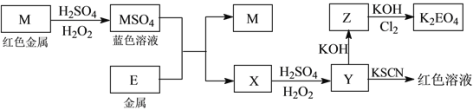
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:_______________________________。
(2)检验X中阳离子的方法和现象是__________________________________________________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:_______________________________、____________________________________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 __________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
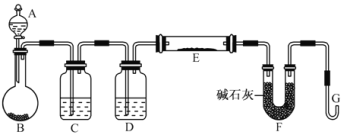
①仪器B中应装入___________,装置D的作用_________________________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
___________________________在这两步之间还应进行的操作是_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1![]()
![]() 溶液与0.1
溶液与0.1![]()
![]() 溶液等体积混合,所得溶液中:
溶液等体积混合,所得溶液中:![]()
B. 20![]() 0.1
0.1![]()
![]() 溶液与10
溶液与10![]() 0.1
0.1![]()
![]() 溶液混合后溶液呈酸性,所得溶液中:
溶液混合后溶液呈酸性,所得溶液中:![]()
C. 室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合,所得溶液中:
的氨水等体积混合,所得溶液中:![]()
D. 0.1![]()
![]() 溶液与0.1
溶液与0.1![]()
![]() 溶液等体积混合,所得溶液中:
溶液等体积混合,所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是_______,其中含有_______ mol H,含有_______g O。
(2)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
②NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,物质的量最大的是__________,含分子个数最多的是________,含原子个数最多的是_________,质量最大的是__________(填字母)。
A.6g氢气 B.0.5molCO2 C.1.204×1023个CO分子 D.147g H2SO4 E.92g乙醇(C2H5OH)
(2)NA表示阿伏加德罗常数的值
①1.204×1023个水分子中共________mol氢原子。
②某气体在同温同压下对H2相对密度为32,则该气体的相对分子质量为__________。
③某气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是___g/mol。
④25g CuSO4·5H2O晶体中含有氧原子______个。
⑤16gO2含有的氧分子数与______g CO2含有的氧原子数相等。
⑥标准状况下,11.2 L CH4中含有的氢原子数为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年长庆油田油气产量当量为5480万吨,自2014年后再次成为中国产量最大的油田。下列关于石油的说法正确的是
A.石油属于可再生矿物能源
B.石油主要含有碳、氢两种元素
C.石油的裂化是物理变化
D.石油分馏的各馏分均是纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com