
分析 2min末已生成0.2molW,则v(W)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),又知z(Z)=0.1mol/(L•min),则n:2=0.1:0.05=2:1,n=4,则
3X+Y=4Z+2W
起始 0.6 0.4 0 0
转化 0.3 0.1 0.4 0.2
2min末 0.3 0.3 0.4 0.2
以此来解答.
解答 解:(1)2min末已生成0.2molW,则v(W)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),又知z(Z)=0.1mol/(L•min),则n:2=0.1:0.05=2:1,n=4,
答:上述反应中Z气体的计量数n的值是4;
(2)3X+Y=4Z+2W
起始 0.6 0.4 0 0
转化 0.3 0.1 0.4 0.2
2min末 0.3 0.3 0.4 0.2
则述反应在2min末时,Y的转化率$\frac{0.1}{0.4}×100%$=25%,
答:述反应在2min末时,Y的转化率为25%;
(3)2min末时,X的物质的量为0.3mol,则浓度为$\frac{0.3mol}{2L}$=0.15 mol•L-1,
答:上述反应在2min末时,X的浓度为0.15 mol•L-1.
点评 本题考查化学平衡的计算,为高频考点,题目涉及化学平衡的三段式计算应用,转化率、浓度概念的计算分析,有利于培养学生的计算能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 硫酸是常用的化学试剂和重要的化工原料.实验室中我们用浓硫酸做过如下实验.
硫酸是常用的化学试剂和重要的化工原料.实验室中我们用浓硫酸做过如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75% | B. | 50% | C. | 25% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
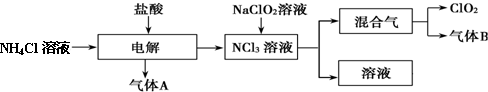
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| x | 温度 | 压强 | SO2的浓度 | 加入催化剂 |
| y | 容器内气体密度 | CO2的体积分数 | 平衡常数 | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该条件下Z是气态 | B. | 平衡常数K=$\frac{c(Z)•c(W)}{c(X)•c(Y)}$ | ||
| C. | 增加Z平衡逆向移动 | D. | 上述过程中X的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:P4(白磷,s)═4P(红磷,s)△H<0,则白磷比红磷稳定 | |
| B. | 由CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2658 kJ•mol-1可知正丁烷的标准燃烧热为2658 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1 N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1 则2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-746 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com