
【题目】下列实验现象预测正确的是( )

A. 实验I:电流表A指针偏转,碳棒上有红色固体析出
B. 实验II:电流表A指针偏转,铁极上有无色气体产生
C. 实验Ⅲ:碳棒上有无色气体产生,铁极上有黄绿色气体产生
D. 实验IV:粗铜上有红色固体析出,精铜溶解
科目:高中化学 来源: 题型:
【题目】如图所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,玻璃管B中装有CuO(用石棉绒作载体)。请回答下列问题:

(1)向试管A中鼓入空气的目的是_____________________________。
(2)玻璃管中可观察到的现象是_______________________________;相关化学方程式是_____________________________________。
(3)试管C中放的是蒸馏水,在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨是人类科技发展史上的一项重大突破。已知:25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:
2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:
①其他条件不变时,升高温度,化学反应速率______(填“增大”或“减小”);
②25℃时,取1mol N2和3mol H2置于2L的密闭容器中,在催化剂存在下进行反应,达到平衡时放出的热量________
A.大于92.4 kJ
B.等于92.4 kJ
C.小于92.4 kJ
③一定条件下,上述反应达到化学平衡状态的标志是_______;
A.N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗amol N2,同时生成2amol NH3
④25℃时,上述反应平衡常数的表达式为:K=_________________。
(2)如图是电解NaCl溶液的示意图。请回答下列问题:

①石墨电极上的反应式为______________;
②电解一段时间后,溶液的pH_________(填“增大”、“减小”或“不变”)。
(3)水溶液中的离子平衡是化学反应原理的重要内容。请回答下列问题:
①常温下,0.1mol/LCH3COONa溶液呈______(填“酸”、“碱”或“中”)性,溶液中c(Na+)_______c(CH3COO-)(填“>”、“<”或“=”);
②常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,水的电离程度大小关系是:0.1mol/L盐酸______0.1mol/LNH4Cl溶液(填“>”、“<”或“=”);
③已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,生成沉淀量的关系是:m(AgCl)_______m(AgBr)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铁矿(主要成分为FeS2)为原料进行如下实验探究。为测定黄铁矿中硫元素的质量分数,将m1g该黄铁矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品。
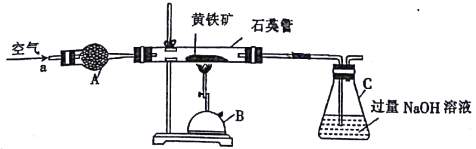
(1)仪器B的名称是________________。
(2)仪器A的作用是______________,锥形瓶C中NaOH溶液的作用是______________。
(3)反应结束后将锥形瓶C中的溶液进行如下处理:

①操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法为______________________。
②上述流程中生成固体反应的离子方程式为__________________。
③经过分析,向m2g固体中加入过量稀盐酸时,无明显现象,则该黄铁矿中硫元素的质量分数为____(用含m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A只由碳、氢两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。一定条件下,A、B、C、D、E、F、G有如下转化关系。

(1)请写出鉴别A和丙烷的实验操作、现象和结论:______________________。
(2)物质D中所含官能团的名称为________。C的结构简式为________。
(3)写出D与G反应的化学方程式:________。
(4)在实验室中获得的E物质往往是含有G物质和D物质的粗产品,要想获得较为纯净的E物质,可以加入的试剂是________,相关分离操作方法是________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2·2H2O的主要流程如下:

(1)与液溴的反应温度不能超过40℃的原因是 。
(2)滤渣的成分可能是 。
(3)试剂M是 ,加入M的目的是 。
(4)操作Ⅱ的步骤为蒸发浓缩、 、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式 。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为 。(相对原子质量:Ca—40 Br—80 H—1 O—16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们的衣食住行中都蕴含着丰富的化学知识,下列说法中正确的是
A.衣料中的蚕丝和涤纶都属于合成有机高分子材料
B.加碘食盐和铁强化酱油都可以补充人体必需的微量元素
C.建筑高楼大厦时用到的钢是纯净物
D.用液化石油气代替汽油作汽车燃料,不会造成空气污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com