
| A. | 碱性锌锰电池中,MnO2是催化剂 | |
| B. | 铜锌原电池工作时.Zn被氧化为Zn2+ | |
| C. | 放电时.铅酸蓄电池中硫酸浓度不断增大 | |
| D. | 氢氧燃料电他中.通氢气的一极为正极 |
分析 A、二氧化锰的化合价降低,在正极得电子;
B、铜锌原电池工作时.锌活泼在负极发生氧化反应;
C、根据放电时铅酸蓄电池反应判断硫酸浓度变化;
D、氢氧燃料电他中,燃料作负极.
解答 解:A.碱性锌锰电池中,MnO2中Mn元素化合价降低,发生还原反应,作氧化剂,故A错误;
B.铜锌原电池工作时.锌活泼在负极发生氧化反应,Zn被氧化为Zn2+,故B正确;
C.铅酸蓄电池总电池反应为:PbO2+2H2SO4+Pb$\frac{\underline{\;放电\;}}{充电}$2PbSO4+2H2O,可知放电时铅酸蓄电池硫酸浓度不断减小,故C错误;
D.氢氧燃料电他中,燃料作负极,所以通氢气的一极为负极,故D错误;
故选B.
点评 本题考查原电池工作原理、电极判断、电极反应等,难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | 酸性KMnO4溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
在容积均为500mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1molN2和2.5molH2,三个容器的反应温度分别为T1,T2,T3,且恒定不变.在其他条件相同的情况下发生反应:N2+3H2?2NH3△H<0.实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A. | 当v(H2)=3v(N2)时.可以说明三个容器中的反应达平衡状态 | |
| B. | 在t min时,一定达化学平衡状态的是III | |
| C. | 在t min时测得Ⅲ中c(N2)=1mol•L-1,若再向Ⅲ中充人1.5molN2和1molNH3,H2的转化率增大 | |
| D. | 三个容器中的反应均达到平衡后.氨气的质量分数Ⅰ>Ⅱ>Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
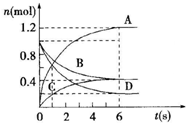 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D═6A+2C | |
| B. | 反应进行到6s时v(B)=v(C) | |
| C. | 反应进行到6s时,用B表示的平均反应速率为0.05mol•L-1•s-1 | |
| D. | 反应进行到6s时,反应停止了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
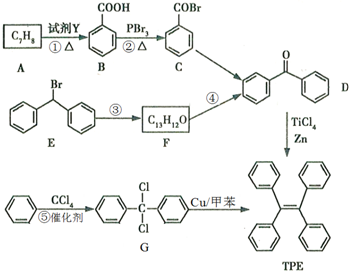
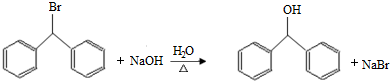 .
.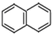 )的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).
)的一元取代物;②能发生银镜反应.满足条件的W的结构简式共有4种(不考虑顺反异构).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com