
| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
分析 A、氧气所处的状态不明确;
B、氯气和铁反应后变为-1价;
C、硫酸氢钠固体由钠离子和硫酸氢根离子构成;
D、在常温下,水的离子积为10-14,在标况下,水的离子积小于10-14.
解答 解:A、氧气所处的状态不明确,故氧气的体积无法计算,故A错误;
B、氯气和铁反应后变为-1价,故1mol氯气反应后转移2NA个电子,故B错误;
C、硫酸氢钠固体由钠离子和硫酸氢根离子构成,故0.1mol硫酸氢钠固体中含0.2NA个离子,故C正确;
D、在常温下,水的离子积才为10-14,在标况下,水的离子积小于10-14,故标况下pH=13的氢氧化钠溶液中,氢离子浓度为10-13mol/L,故氢氧根的浓度小于0.1mol/L,则1L溶液中含有的氢氧根的个数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
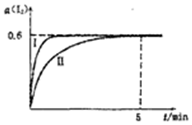 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含142gNa2SO4 | B. | 1L溶液中含有1molNa+ | ||
| C. | 将142gNa2SO4溶于1L水中配成溶液 | D. | 1L水中含有1molNa2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取NaCl固体2.9 g | |
| B. | 胶头滴管加水定容时,有少量水滴到容量瓶外 | |
| C. | 定容时俯视读数 | |
| D. | 称量固体时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由一种元素组成的物质一定是单质 | |
| B. | 凡是能电离出H+的化合物都是酸 | |
| C. | 碱能电离出OH-而使溶液显碱性,但溶液显碱性的不一定是碱 | |
| D. | 氨溶于水形成的溶液能导电,所以氨是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中有少量蒸馏水 | |
| B. | 溶液从烧杯转移到容量瓶后没有洗涤烧杯 | |
| C. | 未冷却即将溶液转移到容量瓶 | |
| D. | 定容时俯视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).
在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
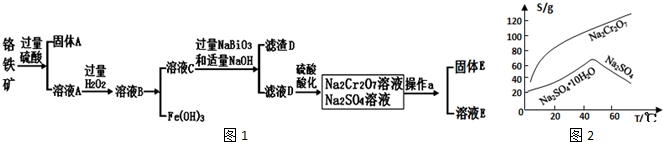
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com