

(1)判断硬质玻璃管中已开始发生反应的方法是____________________________________。
(2)反应过程中发生的现象是_______________________________________________。
(3)在A处点燃可见蓝色火焰的原因是_________________________________________。
(4)实验结束时应注意的操作是_____________________________________________。
①先停止通入CO;
②先熄灭酒精灯,并继续通入CO;
③熄灭酒精灯,同时停止通入CO;
④先熄灭酒精灯,继续通入CO,并点燃排出的CO气体。
科目:高中化学 来源: 题型:
 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

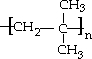
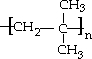
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
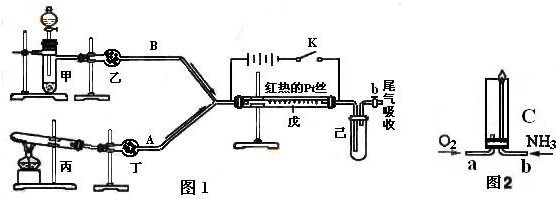
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:058
根据下图所示的实验装置和试剂进行实验:
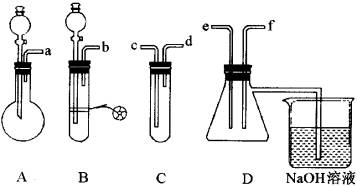
试剂:①盐酸 ②溴水 ③亚硫酸钠 ④硫化亚铁 ⑤硫酸铜 ③品红溶液
(1)A装置主要是________等仪器组装起来的。
(2)要制取SO2气体,证明它既有氧化性,又有还原性并组装一套装置。
(A)按实验的连接顺序,请把上图中a-f各导管口连接起来:________。
(B)上图A—C装置中加入的试剂是(填写代号):A________,B________,C________。
(C)表现SO2还原性的实验是在________装置中(填写代号)进行的。
(D)表现SO2氧化性的实验是在________装置中(填写代号)进行的。
(E)D烧杯中的NaOH溶液的作用是________。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
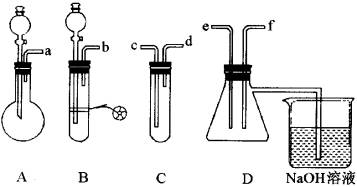
试剂:①盐酸 ②溴水 ③亚硫酸钠 ④硫化亚铁 ⑤硫酸铜 ③品红溶液
(1)A装置主要是________等仪器组装起来的。
(2)要制取SO2气体,证明它既有氧化性,又有还原性并组装一套装置。
(A)按实验的连接顺序,请把上图中a-f各导管口连接起来:________。
(B)上图A—C装置中加入的试剂是(填写代号):A________,B________,C________。
(C)表现SO2还原性的实验是在________装置中(填写代号)进行的。
(D)表现SO2氧化性的实验是在________装置中(填写代号)进行的。
(E)D烧杯中的NaOH溶液的作用是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com