
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向25mL冷水与沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
| C | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 向饱和Na2CO3溶液中加入BaSO4固体,振荡、过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)>Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁离子水解为吸热反应;
B.淀粉水解生成葡萄糖,检验葡萄糖应在碱性溶液中,且淀粉遇碘变蓝;
C.向硝酸银溶液中滴加过量氨水,生成银氨络离子;
D.向饱和BaCO3溶液中加入BaSO4固体,Qc(BaCO3)>Ksp(BaCO3).
解答 解:A.铁离子水解生成胶体,则由操作和现象可知,温度升高,Fe3+的水解程度增大,水解反应为吸热反应,故A正确;
B.淀粉水解生成葡萄糖,检验葡萄糖应在碱性溶液中,且淀粉遇碘变蓝,没有检验是否存在淀粉,不能确定淀粉水解程度,故B错误;
C.向硝酸银溶液中滴加过量氨水,生成银氨络离子,滴加过程中先生成白色沉淀,后溶解,现象不合理,故C错误;
D.向饱和BaCO3溶液中加入BaSO4固体,Qc(BaCO3)>Ksp(BaCO3),则生成碳酸钡沉淀,再加盐酸有气体,结论不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握盐类水解、沉淀的转化、物质的性质、现象与结论的关系、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 从海水中可提取食盐 | B. | 海水蒸馏可得淡水 | ||
| C. | 直接电解海水可得镁 | D. | 从海水中可提取溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
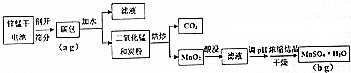
| 酸的种类 | 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 硫酸 | 1:1 | 96.2 | 95.1 |
| 盐酸 | 1:1 | 95.1 | 94.6 |
| 硝酸 | 1:1 | 94.5 | 94.7 |
| 磷酸 | 1:1 | 58.4 | 42.3 |
| 浓度 | 锌的浸取率/% | 锰的浸取率/% |
| 1:1 | 96.2 | 95.1 |
| 1:2 | 90.4 | 88.5 |
| 1:3 | 87.3 | 82.4 |
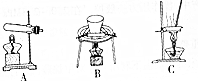
| Mn(OH)2 | Al(OH)3 | |||||
| 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 | 开始溶解 | 完全溶解 | |
| PH | 8.2 | 9.8 | 3.7 | 5.2 | 7.8 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中结构式为O-C-O的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[ ]2-Na+和 ]2-Na+和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
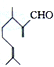 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(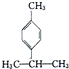 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 对异丙基甲苯的分子式为C10H14 | |
| B. | 香叶醛的一种同分异构体可能是芳香醇 | |
| C. | 两者互为同分异构体 | |
| D. | 两者均能与溴水反应加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径大小:Z>X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>Z | |
| C. | W分别与Y、Z形成的化合物均易溶于水 | |
| D. | X的单质既能和酸反应,又能和碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验装置 | 现象 |
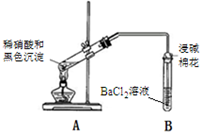 | 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现红棕色气体 3B试管中出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com