
下列物质中,既有离子键,又有非极性共价键的是
| A.H2O | B.CaCl2 | C.KOH | D.Na2O2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下图是两个氢原子相互接近时的能量变化图,则有关该图的说法正确的是
| A.y代表两原子之间的核间距 |
| B.x代表体系具有的能量 |
| C.a代表核外电子自旋相反的两个氢原子能量变化 |
| D.A点时表示两原子间形成了稳定的共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
观察下列模型并结合有关信息,判断有关说法正确的是
| | 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl |
| 结构模型示意图 | 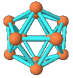 |  |  | 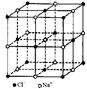 |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.若把H2S分子写成H3S分子,违背了共价键的饱和性 |
| B.晶体中若有阳离子一定有阴离子 |
| C.金属键存在于任何含金属元素的物质中 |
| D.晶体中一定存在化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:
下列说法不正确的是
| A.①和②变化过程中都会放出热量 |
| B.氯原子吸引电子的能力强于钠原子和氢原子 |
| C.①和②中的氯原子均得到1个电子达到8电子稳定结构 |
| D.NaCl中含有离子键,HCl中含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4。下列关于NaHSO4的说法中正确的是( )
| A.因为NaHSO4是离子化合物,因此能够导电 |
| B.NaHSO4固体中阳离子和阴离子的个数比是2:1 |
| C.NaHSO4固体熔化时破坏的是离子键和共价键 |
| D.NaHSO4固体溶于水时既破坏离子键又破坏共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com