
设NA表示阿伏加德罗常数的值,下列说法中正确的
①一定条件下定容容器中充入3molH2(g)和1molN2(g)发生反应:3H2(g)+N2(g) 2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA
②常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA
③14.2g硫酸钠固体中含有0.1NA个硫酸钠分子;
④2gD216O中含有的质子数中子数电子数均为NA
⑤标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
⑥将100mL0.1mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
A.①③⑥ B.④⑤⑥ C.①②④ D.①⑥
科目:高中化学 来源:2014-2015学年甘肃省天水市秦安县高三第一次模拟考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,T列说法正确的是
A.一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA
B.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
C.11 g超重水(T2O)含中子数为5NA
D.常温常压下,11.2 L Cl2含氯原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第二次教学质量检测理综化学试卷(解析版) 题型:填空题
(15分)X、Y、Z、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次个层电子少数2,W的内层电子已充满,最外层只有一个电子。请回答:
(1)X元素在周期表中的位置是 ;W2+离子的核外电子排布式
(2)Y离子和Z离子比较,半径较大的是 (写离子符号),Z元素和氧元素的简单气态氢化物沸点不同的原因是
(3)Z元素的非金属性比 强,可由一复分解反应推测而得,其反应的化学方程式为
(4)X单质易溶于X与Z形成的三原子化合物中,该化合物分子中的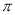 键与
键与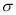 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
(5)用H2O2和Z元素最高价氧化物对应水化物的混合溶液可溶解W单质粉末,已知:
①W(s)+2H+(aq)=W2+(aq)+H2(g) H=-64.39KJ/mol
②2H2O2(l)=2H2O(l)+O2(g) H=-196.46KJ/mol
③H2(g)+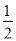 O2(g)= H2O(l) H= -285.84 KJ/mol
O2(g)= H2O(l) H= -285.84 KJ/mol
则在Z元素最高价氧化物对应水化物的溶液中,W与H2O2反应生成W2+与H2O的热反应化学方程式为
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省上饶市高三上学期第一次联考化学试卷(解析版) 题型:选择题
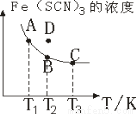
FeCl3溶液与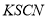 溶液混合,发生反应:Fe3+(aq)+3SCN-(aq)=Fe(SCN)3(aq) △H,其中
溶液混合,发生反应:Fe3+(aq)+3SCN-(aq)=Fe(SCN)3(aq) △H,其中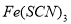 的浓度与温度
的浓度与温度 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
A.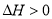
B.反应处于D点时,一定有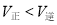
C.溶液中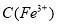 :A点>B点
:A点>B点
D.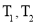 时相应的平衡常数分别为
时相应的平衡常数分别为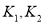 则
则
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省上饶市高三第二次高考模拟化学试卷(解析版) 题型:实验题
(14分,每空2分)乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表:
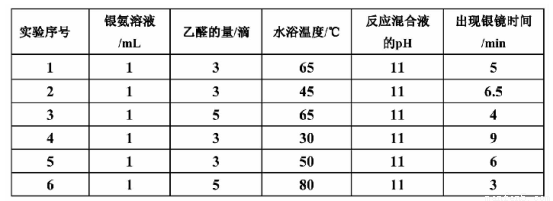
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是 。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间范围是 。
(3)进一步实验还可探索 对出现银镜快慢的影响。
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程如下:
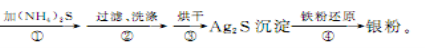
(4)操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉,反应的化学方程式为 。过滤需要用到的玻璃仪器有 (填编号)。
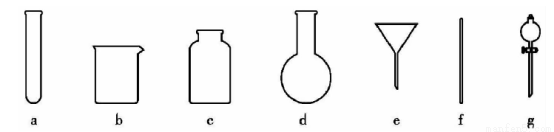
(5)操作④应在 (填实验室设备名称)中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期末考试化学试卷(解析版) 题型:实验题
B.[实验化学]
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100 g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备在三颈圆底烧瓶中进行,并使用了分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。实验需要的药品:浓硫酸、冰醋酸和正丁醇。
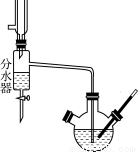
(1)有同学拟通过核磁共振氢谱鉴定所得产物中是否含有正丁醇,正丁醇的氢谱线中的几个峰的面积之比是________。
(2)反应前三颈圆底烧瓶中先加人适量沸石,然后依次加入________。
(3)分水器的作用________。
Ⅱ.乙酸正丁酯粗产品的精制。
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用________洗涤有机层,用分液法分离上述有机层和水层,分液完成后,取出有机层的操作是________。
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品。
Ⅲ.计算产率
如果实验中加入了18.5 mL正丁醇、15.4 mL冰醋酸和2 mL浓硫酸,实验后制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期末考试化学试卷(解析版) 题型:选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:
A(g)+xB(g) 2C(g) ΔH=a kJ·mol-1
2C(g) ΔH=a kJ·mol-1
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下表和下图:
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
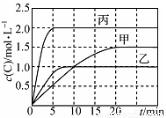
下列说法不正确的是
A.10 min内甲容器中反应的平均速率v(A)=0.10 mol·L-1·min-1
B.其他条件不变,甲容器中在20 min后,降低温度,平衡向正反应方向移动
C.保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,则反应达到新平衡前v(逆)>v(正)
D.T2 ℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,平衡时C的体积分数大于25%
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省哈尔滨市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(16分)在氮单质和常见化合物中:
(1)常用作保护气(如填充灯泡、焊接保护等)的物质是 。原因是 。
(2)常用作制冷剂的物质是 ,原因是 。
(3)能与酸反应生成盐、在常温下为气态的物质是 写出它与HCl等强酸反应的离子方程式: 。
(4)在通常状况下是晶体、易溶于水、可以作氮肥、遇碱会放出带刺激性气味气体的物质是 ,写出它们与NaOH等强碱溶液反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省哈尔滨市高二下学期第一次月考化学试卷(解析版) 题型:选择题
有机物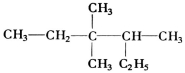 的正确命名为
的正确命名为
A.2-乙基-3,3-二甲基-4-乙基戊烷
B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基已烷
D.2,3,3-三甲基已烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com