
过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。
已知:2Na2CO3+3H2O2=2Na2CO3·3H2O △H<0;回答下列问题:
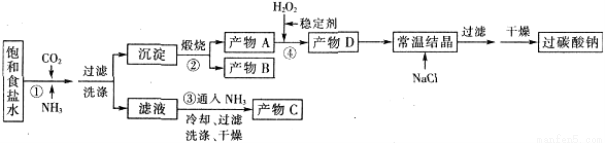
(1)下列物质可使过碳酸钠较快失效的是(填序号)_________。
A. FeCl3溶液 B. H2S C. 稀硫酸 D. NaHCO3溶液
(2)反应①应先通入的气体是__________。
(3)在上述流程中,向反应前的H2O2中加入稳定剂的作用是____________________。
(4)该生产流程中可循环使用的物质是______________________________(填化学式)。
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,请简述该步操作过程___________。
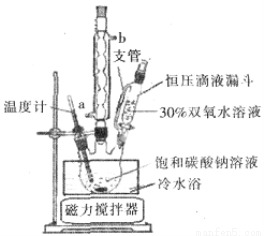
(6)实验室利用下图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是_______,冷凝管应从__________处进水。
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是_______________。
T/℃ | 活性氧百分含量 | 产率 |
5~10 | 13.94 | 85.49 |
10~15 | 14.02 | 85.78 |
15~20 | 15.05 | 88.38 |
20~25 | 14.46 | 83.01 |
 、
、
(1)ABC(3分) (2)NH3(2分) (3)防止双氧水分解(2分) (4)CO2(2分)
(5)沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次(2分) (6)使液体顺利流下;a(2分) (7)15~20℃(2分)
【解析】
试题分析:(1)过碳酸钠(Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,则A、FeCl3溶液能与碳酸钠反应,因此氯化铁也与过碳酸钠反应,A正确;B.H2S与双氧水发生氧化还原反应,则也与过碳酸钠发生氧化还原反应,B正确;C.稀硫酸与碳酸钠反应,因此也与过碳酸钠反应,C正确;D.NaHCO3溶液与碳酸钠以及双氧水等均不反应,因此也与过碳酸钠不反应,D不正确,答案选ABC。
(2)二氧化碳在水中的溶解度很小,而氨气极易溶于水,所以反应①应先通入的气体是氨气。
(3)由于双氧水稳定性差,易分解,因此向反应前的H2O2中加入稳定剂的作用是防止双氧水分解。
(4)碳酸氢钠分解生成碳酸钠、水和二氧化碳,即A是碳酸钠,B是二氧化碳,因此该生产流程中可循环使用的物质是CO2。
(5)从溶液中过滤出固体后,需要洗涤沉淀,因此该步操作是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次。
(6)恒压滴液漏斗能保持压强恒定,因此恒压滴液漏斗中支管的作用是使液体顺利流下。冷凝管应从下端进水,即a处进水上端出水。
(7)根据下表数据可知温度超过20℃后,活性氧百分含量和产率均降低,所以反应最佳的温度选择的范围是15~20℃。
考点:考查物质制备实验流程的 分析与判断以及反应条件选择等


科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
在2L密闭容器中,保持恒温,加热KClO3和MnO2固体混合物制取O2,5min后,生成O232克,则此反应的平均速率可表示为( )
A . v(O2)=3.2g·L-1·min-1 B. v(O2)=0.1 mol·L-1·min-1
C. v(KCl)=0.1 mol·L-1·min-1 D. v(KClO3)=0.0667 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
在指定的条件下,下列各组离子能大量共存的是( )
A.使甲基橙变红的溶液中:Fe2+、Na+、I-、NH4+
B.强碱性溶液中:K+、Na+、ClO-、S2-
C.0.1 mol·L-1 NaAlO2溶液中:H+、Na+、Cl-、SO42-
D.由H2O电离出的c(H+)=10-11mol/L溶液中:Na+、HCO3-、AlO2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
某无色的混合气体可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL该气体经过如图实验的处理, 结果得到酸性溶液,而几乎无气体剩余,则此气体的组成为( )

A.NH3、NO2、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
已知1~18号元素的离子aW3+、bX+、cY2-、dZ - 都具有相同的电子层结构,下列关系正确的是( )
A.离子的还原性:Y2->Z- B.质子数:c>b
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:选择题
在不同温度下,水溶液中c(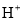 )与c(
)与c(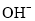 )有如图所示关系,下列有关说法正确的是
)有如图所示关系,下列有关说法正确的是
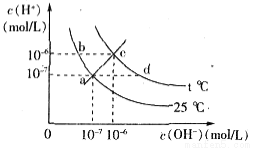
A. c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32-
B. 将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点
C. t℃>25℃
D. ac线上的任意一点均有pH=7
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省盟校高三第二次联考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
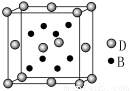
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
请回答下列问题:
(1)C-的电子排布式为______________;E元素原子的价电子排布式为________。
(2)元素B与氮元素可以形成化合物NB3,其中N—B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。
(3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是 。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为 。
(5)含有D元素的化合物焰色反应为______色,焰色反应的原理是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省协作体高三第二次联考理综化学试卷(解析版) 题型:选择题
(14分) 碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g)  CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH= +131.3 kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1
则CO(g)+H2O(g) CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其他条件不变,降低温度,反应达到新平衡前v(逆)______v(正)(填“>”、“<”、“=”)
②该温度下此反应的平衡常数K=___________
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:选择题
将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为
A. mol·L-1 B.
mol·L-1 B. mol·L-1
mol·L-1
C. mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com