
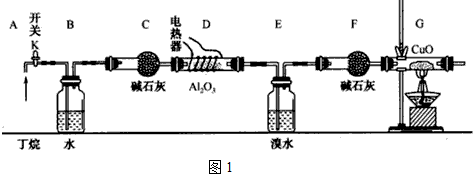
分析 (1)根据实验时应先检验气密性,赶出内部气体,再加热;
(2)根据可燃气体的验纯操作方法分析;
(3)通过观察气泡,可以控制气体的流速;
(4)E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,丁烷的裂解中,生成乙烯的物质的量和乙烷的物质的量相等,甲烷和丙烯的物质的量相等,再结合原子守恒计算甲烷和乙烷的物质的量之比;
(5)①互不相溶的液体采用分液的方法分离,互溶的液体采用蒸馏的方法分离;
②亚硫酸钠具有还原性,能和溴反应除去溴.
解答 解:(1)应先检查整套装置的气密性,排出装置中的空气,再给D、G装置加热,所以正确的操作顺序为:②③①,故答案为:②③①;
(2)在装置G的末端收集一小试管气体堵住管口,靠近火焰,松开手指,若没有爆鸣声,则空气排尽,
故答案为:打开K,使丁烷气依次流经各装置,在装置G的末端收集一小试管气体堵住管口,靠近火焰,松开手指,若没有爆鸣声,则空气排尽;
(3)B装置中盛有水,可以通过观察B中产生的气泡快慢来控制气体的流速,
故答案为:通过观察气泡,调节K,控制气体流速;
(4)丁烷的裂解中生成的乙烯和乙烷的物质的量相等,生成的甲烷和丙烯的物质的量相等,E、F吸收的是烯烃,设C2H4的物质的量为x,C3H6的物质的量为y,乙烷和甲烷的物质的量分别是x、y,则:28x+42y=1.82g,
G减少的质量是氧化铜中的氧元素质量,乙烷和甲烷和氧化铜反应需要的氧原子的物质的量为:2(2x+y)+$\frac{6x+4y}{2}$=$\frac{4.16}{16}$,
解得:x=0.02mol、y=0.03mol,
所以:n(CH4):n(C2H6)=3:2,
故答案为:3:2;
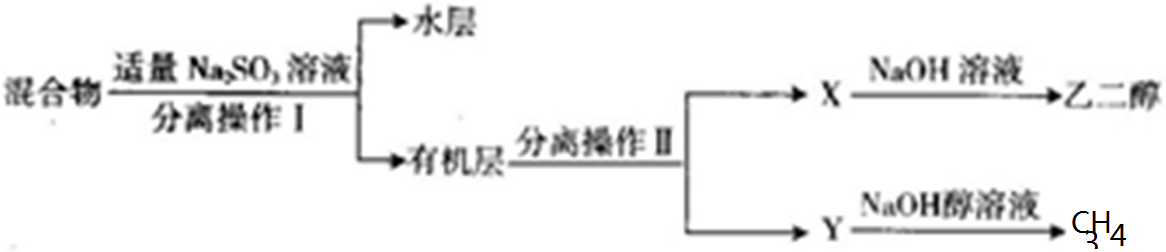
(5)混合物中含有有机物和溴,向混合物中加入亚硫酸钠溶液后,溶液分层,采用分液的方法分离出混合物和有机层,互溶的液体采用蒸馏的方法分离,分离出甲和乙,
①互不相溶的液体采用分液的方法分离,互溶的液体采用蒸馏的方法分离,所以操作I、操作II分别是分液、蒸馏,
故答案为:分液;蒸馏;
②亚硫酸钠具有还原性,能和强氧化性物质溴反应而除去溴,反应的离子方程式为:SO32-+Br2+H2O=SO42-+2Br-+2H+,故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+.
点评 本题考查实验操作、实验计算、物质分离和提纯的方法等知识点,题目难度中等,难点是计算甲烷和甲烷的物质的量之比,明确质量增加的量和质量减少的量分别是什么物质是解本题的关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
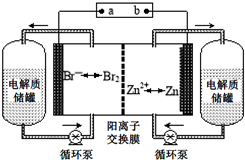 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 放电时负极的电极反应式为Zn-2e-═Zn2+ | |
| D. | 阳离子交换膜可阻止Br2与Zn直接发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中m(Al3+)为5.4g | B. | 混合溶液中c(Mg2+)为0.5mol/L | ||
| C. | 混合溶液的pH=2 | D. | 混合溶液中c(Cl-)为1.7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
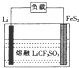 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷和异丁烷互为同分异构体 | |
| B. | 乙醇和乙酸都能与氢氧化钠溶液反应 | |
| C. | 淀粉和蛋白质的水解产物都是氨基酸 | |
| D. | 葡萄糖和蔗糖都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 玻璃实验仪器 | 实验试剂 | 温度计位置 |
| A | 制取乙烯 | 圆底烧瓶、集气瓶、导气管、酒精灯 | 浓硫酸、乙醇 | 反应液中 |
| B | 提纯乙醇 | 蒸馏烧瓶、冷凝管、锥形瓶、承接管 | 75%的乙醇 | 支气管口 |
| C | 中和热测定 | 烧杯、环形玻璃搅拌棒 | 氢氧化钠、醋酸 | 酸、碱及反应液中 |
| D | 制银镜 | 烧杯、试管、酒精灯 | 银氨溶液、葡萄糖 | 水浴的烧杯水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com