
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
分析 A.少量氯气先氧化亚铁离子,电荷不守恒;
B.钠和水反应生成氢氧化钠和氢气;
C.醋酸是弱电解质,要写化学式;
D.向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全,则二者以1:1反应,反应生成硫酸钡、一水合氨和水.
解答 解:A.少量氯气先氧化亚铁离子,电荷不守恒,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故A错误;
B.钠和水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B正确;
C.醋酸是弱电解质,要写化学式,离子方程式为BaCO3+2CH3COOH═Ba2++H2O+CO2↑+2CH3COO-,故C错误;
D.向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全,则二者以1:1反应,反应生成硫酸钡、一水合氨和水,离子方程式为Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O,故D正确;
故选BD.
点评 本题考查离子方程式正误判断,为高频考点,明确离子性质及离子方程式书写规则即可解答,注意要遵循原子守恒、电荷守恒及转移电子守恒,有些反应还与反应物的量有关,易错选项是A,注意离子反应先后顺序.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
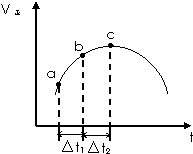 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
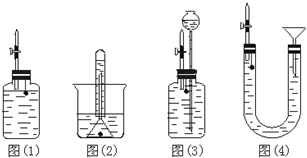 某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.
某研究型学习小组为测定镁和铝的混合物中铝的质量分数,称取该样品a g,溶于200mL 5mol/L HCl溶液中,共收集到标准状况下的氢气3.36L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20g重水(2H2O)含有10NA个电子 | |
| B. | 常温常压下,1摩氦气含有2NA个原子 | |
| C. | 100mL 1mol/L NaHCO3 溶液含有0.1NA个HCO3- | |
| D. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去 0.3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水时,HI分子比HCl分子更容易电离 | |
| B. | HI比HCl熔、沸点都高 | |
| C. | HI比HCl更稳定 | |
| D. | 拆开相同物质的量的HI分子比HCl消耗的能量小,HI是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
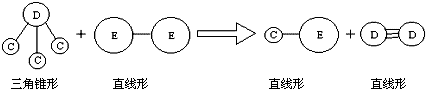
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )
拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )| A. | 属于芳香化合物 | B. | 属于卤代烃 | ||
| C. | 具有酯类化合物的性质 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com