
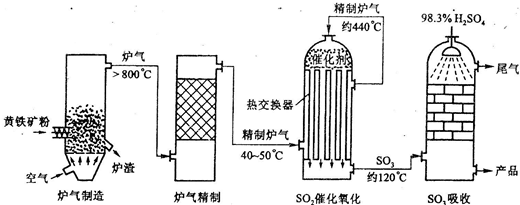
以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)已知: (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(2)沸腾炉中发生反应的化学方程式为 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.沸腾炉排出的矿渣可供炼铁
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.为使黄铁矿充分燃烧,需将其粉碎
(4)在吸收塔吸收SO3不用水或稀硫酸的原因 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表(a>0):

计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g,浓硫酸增加的质量为 。(计算结果保留两位小数)
(1)3.9×105kJ(2分) (2)4FeS2+11O2 4Fe2O3+8SO2(2分)(3)a b d(3分)
4Fe2O3+8SO2(2分)(3)a b d(3分)
(4)SO3与H2O化合时放出大量的热,用水或稀硫酸吸收容易形成酸雾,反而不利于充分吸收SO3(2分)
(5)①SO2+Br2+2H2O=4H++2Br-+SO42-(2分) ②14.56(2分)(14.56%不给分)
2.31g(2分)
【解析】
试题分析:(1)根据热化学方程式可知SO3气体与H2O化合时放出的热量为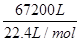 ×130.3kJ/mol=3.9×105kJ。
×130.3kJ/mol=3.9×105kJ。
(2)黄铁矿燃烧燃烧生成SO2和氧化铁,反应的化学方程式为FeS2+11O2 4Fe2O3+8SO2。
4Fe2O3+8SO2。
(3)生产过程中的矿渣中含有三氧化二铁,可以炼铁,a正确;增加空气的量会使平衡正向进行,提高了二氧化硫的转化率,b正确;催化剂只改变速率不改变平衡,不改变转化率,c不正确;粉碎矿石增大接触面积提高反应速率,d正确,所以正确答案选abd。
(4)由于SO3与H2O化合时放出大量的热,用水或稀硫酸吸收容易形成酸雾,反而不利于充分吸收SO3,所以在吸收塔吸收SO3不用水或稀硫酸。
(5)①单质溴具有氧化性,能把SO2氧化生成硫酸,而溴单质被还原为溴离子,因此反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-。
②从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物;本反应历程是:OH-首先是和NH4HSO3中的H+反应,然后OH-再和NH4+反应放出氨气。由题知铵盐质量为30.00g时,产生0.68g÷17g/mol=0.04molNH3。该铵盐中NH4HSO4先与NaOH溶液反应,2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+H2O,只有当NH4HSO4中的H+消耗完全后,NH4+才能与NaOH溶液反应产生NH3,NH4++OH-=NH3↑+H2O。据此判断铵盐质量为10.00g时NaOH溶液过量,铵盐质量为20.00g和30.00g时,消耗的NaOH质量相等。设10.00g铵盐中NH4HSO4 与(NH4)2SO4的物质的量分别为X、Y,n(NH3)=n(OH-)-n(H+),则有:
|
铵盐质量/g |
10.00 |
20.00 |
30.00 |
40.00 |
|
含NH4HSO4、(NH4)2SO4/mol |
X、Y |
2X、2Y |
3X、3Y |
4X、4Y |
|
产生NH3/mol |
X+2Y |
X+2Y |
0.04 |
0 |
|
消耗NaOH/mol |
2X+2Y |
3X+2Y |
3X+0.04 |
3X+0.04 |
因此3X+2Y=3X+0.04,解得Y=0.02mol,又115X+132Y=10.00,得X=0.064mol.则该铵盐中氮元素的质量分数=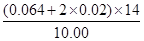 ×100%=14.56%。
×100%=14.56%。
由上面讨论可知此NaOH溶液中共有0.232molNaOH,当铵盐质量为15.00g时含0.096mol NH4HSO4和0.03mol (NH4)2SO4,共有NH4+和H+ 0.252mol,故NaOH不足,此时产生n(NH3)=(0.232-0.096)mol=0.136mol,因此NH3的质量=0.136mol×17g/mol=2.31g。
考点:考查硫酸的工业制备、反应热的计算、反应条件的控制以及物质含量的计算


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:福建省泉州市德化县2010届高三上学期期末考试化学试卷 题型:022
以黄铁矿为原料生产硫酸的工艺流程图如下:
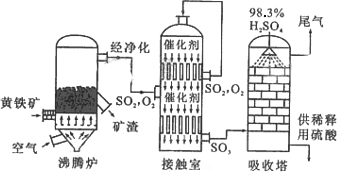
(1)请写出沸腾炉中黄铁矿燃烧的化学方程式:________________.
(2)接触室中2SO2(g)
+O2(g)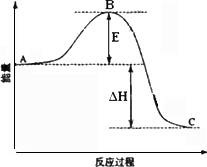
①依据工艺流程图判断下列说法正确的是(选填序号字母)________.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
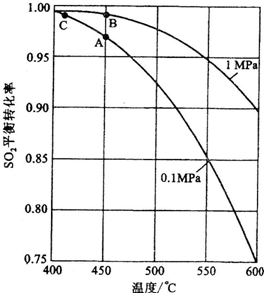
②反应达到平衡时,平衡常数表达式K=________,升高温度,K值________(填“增大”、“减小”或“不变”);图中△H=________KJ·mol-1.
③图中C点表示________,E的大小对该反应的反应热________(填“有”或“无”)影响.该反应通常用V2O5作催化剂,加V2O5会使图中B点________(填“升高”或“降低”).
④如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=________mol·L-1·min-1;
⑤已知单质硫的燃烧热为-296 KJ·mol-1,计算由S(s)生成3 mol SO3(g)的△H=________.
(3)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)FeS2(s)+11/4O2(g)====1/2Fe2O3(s)+2SO2(g);ΔH=-835 kJ·mol-1
(2)SO2(g)+1/2O2(g)====SO3(g);ΔH=-98.3 kJ·mol-1
(3)SO3(g)+H2O(l)====H2SO4(l);ΔH=-130.3 kJ·mol-1
计算将1.0 mol FeS2中的硫全部转化为H2SO4,理论上可产生多少热量?
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即在沸腾炉中煅烧黄铁矿、SO2的催化氧化及其SO3的吸收。请回答下列几个有关硫酸工业中的几个问题。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O ![]() Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )

A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
(2)从沸腾炉中出来的炉气必须经除尘、洗涤、干燥后进入接触室,其主要目的是__________。
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。

(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com