
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
科目:高中化学 来源: 题型:
【题目】某品牌化妆品的主要成分Z具有美白功效,原从杨树中提取,现可用如下图所示反应合成。下列对X、Y、Z的叙述,正确的是

A. X、Y和Z均能和NaOH溶液反应
B. X和Z均能和Na2CO3溶液反应,但不能和NaHCO3溶液反应
C. Y既能发生加聚反应,也能发生缩聚反应
D. Y分子中所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列有关说法正确的是 ( )
A. 医院里的血液透析利用了胶体的性质
B. PM2.5中含有铅、铬、钒、砷等对人体有害的金属元素
C. 工业冶炼铝常用焦炭还原氧化铝
D. 煤经过气化和液化的物理变化可变为清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH__________NaOH溶液的pH(填“>”“=”或“<”);
(2)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积 氨水的体积(填“>”“=”或“<”);
Ⅱ.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250![]() 烧碱溶液
烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为![]()
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积![]()
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写) → → → D →
(2)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响 (填“偏高”、“偏低”或“无影响”)。
(3)该烧碱样品的纯度计算式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下:
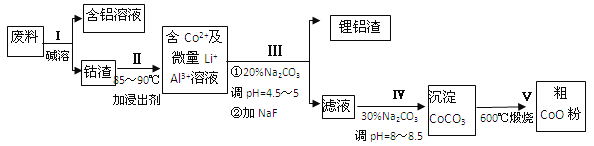
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为 (产物中只有一种酸根).请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.7g 氯化铵固体与足量熟石灰混合加热,使之充分反应。
(1)写出反应的化学方程式:____________________。
(2)生成的氨气在标准状况下的体积是______________L。
(3)用氨可以把一氧化氮还原成氮气,反应的化学方程式为:__________,此反应中氧化产物与还原产物的物质的量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件,可逆反应:mA+nB![]() pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,减小压强可使平衡发生移动,则平衡向____________(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是____________(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)____________v(b)(填“>”、“<”或“=”);

(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(H+)的比值为_________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com