
����Ŀ��(1)25 �棬pH=10��NaOH��Һ��PH=12��NaOH��Һ�������ϣ����Ϻ���Һ�е�PH ԼΪ____________________������֪ lg2=0.3��
(2)T�� ��ˮ�����ӻ�����Kw= 1��10��12����ʹPH=1��������Һ��PH=13��NaOH��Һ��Ϻ�����ԣ���������Һ��NaOH��Һ�������Ϊ_________________��
(3)��֪25 �棬̼��ĵ���ƽ�ⳣ��Ka1= 4.0��10��7��Ka2= 5.6��10��11������¶���NaHCO3��ˮ��ƽ�ⳣ��Kh=________________________��
���𰸡� 11.7 100��1 2.5��10��8
��������(1).25 ����pH=10��NaOH��Һ��c��OH����=1��10-4mol/L��PH=12��NaOH��Һ��c��OH����=1��10-2mol/L�����ߵ������Ϻ�������Һ��c��OH����=![]() ��
��![]() ����c��H+��=
����c��H+��= 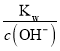 =
= ![]() = 2.0��10-12mol/L����pH= -lgc(H+) = -lg2.0��10-12=11.7���ʴ�Ϊ��11.7��
= 2.0��10-12mol/L����pH= -lgc(H+) = -lg2.0��10-12=11.7���ʴ�Ϊ��11.7��
(2).T�� ��ˮ�����ӻ�����Kw= 1��10��12��PH=1��������Һ��c(H+) =0.1mol/L��PH=13��NaOH��Һ��c��OH����=10mol/L����������Һ�����ΪxL��NaOH��Һ�����ΪyL������ʹ��Ϻ����Һ�����ԣ���xL��0.1mol/L=yL��10mol/L�����x:y=100:1���ʴ�Ϊ��100:1��
(3).HCO3��ˮ��ķ���ʽΪ��HCO3����H2O![]() H2CO3��OH������ˮ��ƽ�ⳣ���ı���ʽΪ��Kh=
H2CO3��OH������ˮ��ƽ�ⳣ���ı���ʽΪ��Kh=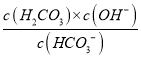 ��̼��ĵ�һ�����뷽��ʽΪ��H2CO3
��̼��ĵ�һ�����뷽��ʽΪ��H2CO3![]() HCO3- + H+����Ka1=
HCO3- + H+����Ka1= 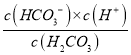 ��25��ʱ��Kw=c(H+)��c(OH-)=1.0��10-14����Kh�ı���ʽ��֪��Kh=
��25��ʱ��Kw=c(H+)��c(OH-)=1.0��10-14����Kh�ı���ʽ��֪��Kh=![]() =
=![]() = 2.5��10��8���ʴ�Ϊ��2.5��10��8��
= 2.5��10��8���ʴ�Ϊ��2.5��10��8��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӽ��ͳɱ��ͼ��ٻ�����Ⱦ�ĽǶȿ��ǣ���ȡ����ͭ��õķ����ǣ� ��
A. ͭ��Ũ���ᷴӦ B. ͭ��ϡ���ᷴӦ
C. ����ͭ��ϡ���ᷴӦ D. �Ȼ�ͭ��Һ����������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.������ȼ����Ϊ��H=��285.5kJ?mol��1 �� ����ˮ���Ȼ�ѧ����ʽΪ2H2O��l�� ![]() 2H2��g��+O2��g����H=+285.5k?Jmol��1
2H2��g��+O2��g����H=+285.5k?Jmol��1
B.��ӦSO2��g��+2H2S��g���T3S��s��+2H2O��l���ڳ��������Է����У���÷�Ӧ�ġ�H��0
C.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g���T2NH3��g����H=��38.6k?Jmol��1
D.��C��ʯī��s��=C�����ʯ��s����H=+1.90 k?Jmol��1��֪�����ʯ��ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.��ҵ����ʯ�����Ʊ�Ư�ۣ�Ca��OH��2+Cl2=Ca2++ClO��+Cl��+H2O
B.�����������Һ�еμ�����Ba��OH��2��Һ��NH4++Al3++2SO42��+2Ba2++5OH��=AlO2��+2BaSO4��+NH3H2O+2H2O
C.�Ʊ�Fe��OH��3���壺Fe3++3H2OFe��OH��3�����壩+3H+
D.��Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO4��+6H++5H2O2=2Mn2++5O2��+8H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ܱ������������淴ӦZ������+W������X��g��+Y��������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ���ǣ� �� 
A.Z��W�ڸ�������������һ����Ϊ��̬
B.t1��t2ʱ�����t3ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ���������������
C.���÷�Ӧֻ��ij�¶�T0�����Է����У���÷�Ӧ��ƽ�ⳣ��K���¶����߶�����
D.���ڸ��¶��´˷�Ӧƽ�ⳣ������ʽΪK=c��X������t1��t2ʱ�����t3ʱ�̺��XŨ�Ȳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6molX�����0.4molY��������2L�����У�ʹ���Ƿ������·�Ӧ��3X������+Y������=nZ������+2W��������5minĩ������0.2molW������֪��ZŨ�ȱ仯����ʾ�Ļ�ѧ��Ӧƽ������Ϊ0.01molL��1min��1 �� ��������Ӧ��Z����ļ���ϵ�� n��ֵ�ǣ� ��
A.1
B.2
C.3
D.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±������ķ���ʽ���й��ɣ��жϿո�������ͬ���칹�����Ŀ��(����)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����ԭ������������������ֶ�����Ԫ�أ���������������������Ԫ�����ڱ��У�Z��Y���ڣ�Z��W���ڣ�
��X�ֱ���Y��Z��W����ɻ�ѧʽΪYX3 �� X2Z��X2W���ֹ��ۻ�����
����գ�
��1��X��Y��Zԭ������������֮����
��2��X2W�Ľṹʽ��
��3��X��Y��Z��ɵ�һ�ֻ�������ǿ�ᣮд�������ϡ��Һ��ͭ��Ӧ�����ӷ���ʽ��Y��Z�������һ��ֻ��X��Z��Һ�壨�ڳ��¡���ѹ�£���Ӧ��������һ�����ӻ������仯ѧʽΪ
��4��X��Y��Z��W���һ�ֻ������ԭ�Ӹ���֮��Ϊ5��1��3��1���û�������л�ԭ�ԣ���д���û����������ϡNaOH��Һ��Ӧ�����ӷ���ʽ�� ��
�������ʵ��֤���û�������л�ԭ�ԣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ij��ɫ��Һ�к������������еļ��֣�Na+��Ba2+��Cl����Br����SO ![]() ��SO
��SO ![]() ��Ϊ��ȷ����Һ����ɣ�ijѧ����������̽��ʵ�飺
��Ϊ��ȷ����Һ����ɣ�ijѧ����������̽��ʵ�飺
����pH��ֽ�����Һ������ԣ���Һ��pH����7
��ȡ������Һ�������еμ���ˮ���ټ���CC14�����ã�CC14�ʳ�ɫ
����ȡ������Һ�������еμ�Ba��NO3��2��Һ��ϡHNO3 �� �а�ɫ��������
���÷�Һ©���������û��Һ���룬�����ϲ���Һ���μ�AgNO3��Һ��ϡHNO3 �� �а�ɫ����������
��������ʵ���жϣ����н�����ȷ���ǣ� ��
A.��Һ��һ������Br����SO ![]()
B.��Һһ������Na+ �� ����Ba2+
C.ʵ������������ӵļ���û�й�ϵ������ʡ��
D.��ʵ��ܿ����ж���Һ�к���Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com